Характерні властивості речовини (фізико-хімічна)
The характерні властивості речовини вони є хімічними або фізичними властивостями, які можуть допомогти ідентифікувати або виділити одну речовину від іншої. Фізичні властивості є характеристиками речовини, що спостерігається з органами почуттів. Хімічні властивості є характеристиками, які описують, як речовина змінюється від однієї речовини до іншої під час хімічної реакції.
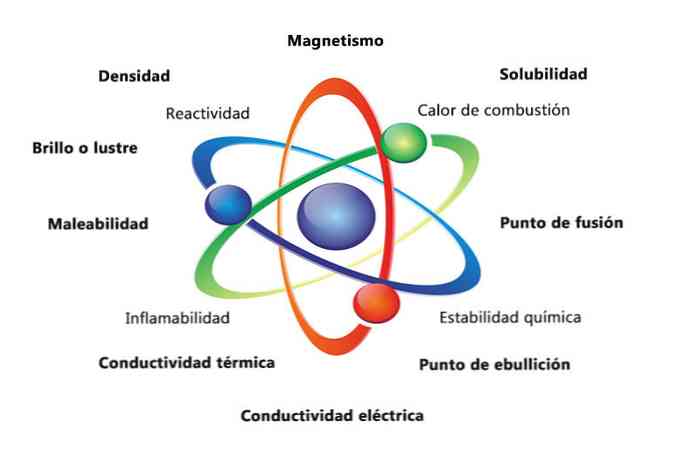
Деякі фізичні властивості речовини - щільність, розчинність, температура плавлення, колір і маса. Хімічні властивості матеріалу включають займистість, реакційну здатність з кислотами і корозію. Деякі приклади того, як властивості матерії можуть допомогти ідентифікувати елемент, полягає в порівнянні щільності різних елементів.
Такий елемент, як золото, має щільність 19,3 грам на кубічний сантиметр, а щільність сірки - 1,96 грам на кубічний сантиметр. Аналогічно, точки плавлення таких речовин, як вода і ізопропіловий спирт, різні.
Фізичні властивості речовини
Фізичні властивості речовини - це властивості, які можна виміряти або спостерігати без зміни хімічної природи речовини. Деякі приклади фізичних властивостей:
- Щільність: кількість речовини, що має об'єкт, обчислюється діленням маси за обсягом.
- Магнетизм: сила тяжіння між магнітом і магнітним об'єктом.
- Розчинність: міра того, наскільки добре речовина може розчинятися в іншій речовині.
- Температура плавлення: температура, при якій речовина змінюється від твердої до рідкої.
- Температура кипіння: температура, при якій речовина змінюється від рідини до газу.
- Електрична провідність: міра того, наскільки добре електричні струми рухаються через речовину.
- Теплопровідність: швидкість, з якою речовина передає тепло.
- Податливість: це здатність речовини прокочуватися або розтиратися різними способами.
- Блиск або блиск: наскільки легко об'єкт відображає світло.
Хімічні властивості речовини
Хімічні властивості описують здатність речовини перетворюватися в нову речовину з різними властивостями. Нижче наведено кілька прикладів хімічних властивостей:
- Теплота згоряння: це енергія, що вивільняється, коли з'єднання проходить повне згоряння з киснем.
- Хімічна стабільність: відноситься до того, чи буде з'єднання реагувати з водою або повітрям (хімічно стабільні речовини не будуть реагувати).
- Займистість: здатність з'єднання горіти при дії полум'я.
- Реактивність: здатність взаємодіяти з іншою речовиною і утворювати одне або кілька нових речовин.
Фізичні стани речовини
Матерія - це все, що займає простір, яке має масу і яке може сприйматися нашими почуттями. Матерія може бути класифікована за своїм фізичним станом: твердим, рідким і газоподібним.
1- Тверді тіла та їх характерні властивості
Всі тверді речовини мають масу, займають простір, мають певний обсяг і форму, не проскакують через простір і не можуть бути стиснутими або мати тверду форму. Як приклад ми маємо: дерево, книги, губки, метал, камені тощо..
У твердих тілах дрібні частинки речовини дуже близько один до одного і торкаються один одного. Частинки настільки близькі один до одного, що вони не можуть багато рухатися, між ними дуже мало місця.
2 - Рідини та їх характерні властивості
Всі рідини мають масу, займають простір, мають певний обсяг, але не мають певної форми (оскільки вони пристосовуються до контейнера, де вони знаходяться), вони можуть бути стиснуті в дуже малій мірі і можуть ковзати через простір. В якості прикладів ми маємо: воду, гас, нафту тощо..
У рідинах дрібні частинки речовини трохи віддалені один від одного, між ними більше місця (порівняно з твердими речовинами) і вони не торкаються один одного. Тому частинки можуть переміщатися між просторами, штовхаючи і стикаючись з іншими частинками, постійно змінюючи напрямок.
3- Гази та їх характерні властивості
Всі гази мають масу, займають простір, не мають певного обсягу або форми, можуть стискатися в значній мірі і можуть дифундувати в космос. Як приклад ми маємо: водень, кисень, азот, діоксид вуглецю, пар і т.д..
У газах дрібні частинки речовини знаходяться набагато далі один від одного, між ними є значно більше простору (порівняно з рідинами) і вони не торкаються один одного. Частинки мають максимальну свободу руху, тому вони штовхають і стикаються з іншими частинками, постійно змінюючи напрямок.
Зміни стану речовини
Матерія може бути перетворена з твердого стану в рідкий стан і навпаки, і з рідкого стану в газоподібний стан і навпаки. Це перетворення приймає назву зміни стану речовини і відбувається шляхом зміни температури:
Fusion
Зміна стану матеріалу від твердого до рідкого шляхом підвищення температури. Коли нагрівається тверда речовина, тепло призводить до більш енергійного вібрації частинок.
При досягненні точки плавлення тверді частинки володіють достатньою кінетичною енергією для подолання енергетичних сил тяжіння, які утримують їх у фіксованих положеннях, і вони розриваються, утворюючи невеликі групи рідких частинок..
Кипіння або випаровування
Зміна стану рідкої речовини до газоподібного за рахунок підвищення температури. Коли нагрівається рідка речовина, тепло робить частинки рухатися ще швидше.
Досягаючи точки кипіння, частинки рідини мають достатню кінетичну енергію для подолання сил тяжіння, які утримують їх у фіксованих положеннях, і розділяються на окремі газоподібні частинки..
Заморожування або затвердіння
Зміна стану рідкої речовини на тверде з допомогою зниження температури. Коли охолоджується рідка речовина, його частинки втрачають багато кінетичної енергії. При досягненні точки замерзання частинки припиняють рух і вібрують у фіксованому положенні, стаючи твердими частинками.
Зрідження або конденсація
Зміна стану газоподібної речовини в рідину за допомогою зниження температури. Коли газоподібне речовина охолоджується, його частинки втрачають багато кінетичної енергії, що змушує їх притягувати один одного, стаючи рідкими частинками.
Сублімація
Деякі матеріали змінюються безпосередньо зі свого твердого стану в газоподібний стан або навпаки, без проходження рідкого стану. Коли ці тверді речовини нагріваються, їх частинки рухаються настільки швидко, що вони розділяють повністю утворюючий пар або газ, і навпаки, коли процес відбувається від газоподібного до твердого речовини.
Список літератури
- De Podesta, М. Розуміння властивостей речовини, 2-е видання. Великобританія: Тейлор і Френсіс.
- Гоель А. Стани матерії. Нью-Делі: Видавництво Діскавері.
- Мур J, Stanitski C. Молекулярна наука, 5-е видання. Stamford: Cengage Learning.
- Рамакрішна А. Природа матерії, 1-е видання. Нью-Делі: Брати Гояла Пракашан.
- Регер Д, Гуд S, Бал Д. Хімія. Принципи та практика, 3-е видання. Канада: Brooks / Cole, Cengage Learning.
- Shapere D. Матерія (фізика). Отримано з: accessscience.com.
- Сінгх Л, Каур М. Матерія в нашому оточенні. Індія: школа Ченда.


