Енергія хімічної активації, з якої вона складається, розрахунок
The енергія хімічної активації (з точки зору кінетичних досліджень) відноситься до найменш можливої кількості енергії, необхідної для початку хімічної реакції. Згідно з теорією зіткнень у хімічній кінетиці, сказано, що всі молекули, що перебувають у русі, мають певну кінетичну енергію.
Це означає, що чим більше швидкість вашого руху, тим більша величина кінетичної енергії. У цьому сенсі молекула, що несе швидкий рух, не може бути розділена на фрагменти сама по собі, тому між нею і іншою молекулою має відбутися зіткнення, так що може відбутися хімічна реакція..
Коли це відбувається - коли відбувається зіткнення між молекулами - частина її кінетичної енергії перетворюється на коливальну енергію. Аналогічно, якщо на початку процесу кінетична енергія висока, молекули, які беруть участь у зіткненні, будуть представляти вібрацію настільки великою, що деякі з присутніх хімічних зв'язків будуть розбиті..
Це розрив зв'язків є першим етапом перетворення реагентів у продукти; тобто у формуванні цих. З іншого боку, якщо на початку цього процесу кінетична енергія має малу величину, то з'явиться явище «відскоку» молекул, через яке вони будуть практично інтактні..
Індекс
- 1 З чого він складається??
- 1.1 Активований комплекс
- 2 Як розраховується?
- 2.1 Розрахунок енергії активації хімічної реакції
- 3 Як енергія активації впливає на швидкість реакції?
- 4 Приклади розрахунку енергії активації
- 5 Посилання
З чого вона складається??
Починаючи від концепції зіткнень між молекулами, щоб ініціювати хімічні реакції, описані раніше, можна сказати, що існує мінімальна кількість енергії, необхідної для зіткнення..
Отже, якщо енергетична цінність менше цього необхідного мінімуму, просто не відбудеться ніяких змін між молекулами після того, як відбудеться зіткнення, а це означає, що коли ця енергія відсутня, задіяні види залишаються практично незмінними і не відбуватимуться. будь-які зміни, викликані цим шоком.
У цьому порядку ідей мінімальна енергія, необхідна для зміни після зіткнення між молекулами, називається енергією активації.
Іншими словами, молекули, що беруть участь у ударі, повинні мати величину загальної кінетичної енергії з величиною, що дорівнює або більше енергії активації, так що може відбутися хімічна реакція.
Крім того, у багатьох випадках молекули стикаються і створюють новий вид, який називається активованим комплексом, структура якого також називається "перехідним станом", оскільки вона існує лише тимчасово..
Вона викликається видами реагуючих речовин внаслідок зіткнення і до утворення продуктів реакції.
Активований комплекс
Зазначений вище активований комплекс утворює вид, який має дуже низьку стабільність, але який, у свою чергу, має велику кількість потенційної енергії.
На наступній схемі показано перетворення реагентів на продукти, виражені в енергетичних показниках, і відзначено, що величина енергії активованого комплексу, що утворюється, значно більша, ніж енергія реагентів і продуктів..
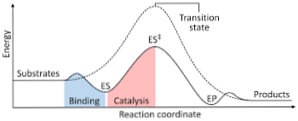
Якщо в кінці реакції продукти мають більшу стійкість, ніж реагентні речовини, то виділення енергії відбувається у вигляді тепла, що дає екзотермічну реакцію..
Навпаки, якщо реагенти призводять до стабільності більшої величини, ніж продукти, це означає, що реакційна суміш виявляє поглинання енергії у вигляді тепла з її оточення, що призводить до ендотермічної реакції..
Аналогічним чином, якщо відбувається один або інший випадок, має бути побудована діаграма, така, як показана раніше, де нанесена потенційна енергія системи, яка реагує на прогрес або прогрес реакції..
Таким чином, отримані зміни потенційної енергії, що відбуваються в процесі реакції, і реагенти перетворюються на продукти.
Як це розраховується?
Енергія активації хімічної реакції тісно пов'язана з константою швидкості цієї реакції, а залежність цієї константи від температури представлена рівнянням Арреніуса:
k = Ae-Ea / RT
У цьому вираженні k являє константу швидкості реакції (яка залежить від температури) і параметр A це називається частотним фактором, і це міра частоти зіткнень між молекулами.
Зі свого боку, e виражає основу ряду природних логарифмів. Воно підвищується до потужності, що дорівнює негативному частці енергії активації (Ea) між продуктом, що утворюється в результаті газової константи (R) і абсолютна температура (T) системи для розгляду.
Слід зазначити, що частотний коефіцієнт можна розглядати як константу в певних реакційних системах в широкому діапазоні температур.
Цей математичний вираз спочатку передбачав хімік голландського походження Якобус Генрік вант Хофф в 1884 році, але який дав їй наукову обгрунтованість і витлумачив її передумову, був уродженим шведським хіміком Сванте Арреніусом у 1889 році..
Розрахунок енергії активації хімічної реакції
Рівняння Арреніуса вказує на пряму пропорційність, що існує між константою швидкості реакції і частотою зіткнень між молекулами.
Також це рівняння може бути представлено більш зручним способом шляхом застосування властивості натуральних логарифмів до кожної сторони рівняння, отримуючи: \ t
ln k = ln A - Ea / RT
При переупорядкуванні термінів для отримання рівняння рядка (y = mx + b) досягається наступний вираз:
ln k = (- Ea / R) (1 / T) + ln A
Отже, при побудові графа ln k в порівнянні з 1 / T отримуємо пряму лінію, де ln k являє собою координату y, (- A / R) являє собою нахил лінії (m), (1 / T) представляє координату x, а ln A являє собою перетин з віссю ординат (b).
Як видно, нахил, що випливає з цього розрахунку, дорівнює значенню -Ea / R. Звідси випливає, що, якщо бажано отримати значення енергії активації за допомогою цього виразу, необхідно виконати просте очищення, в результаті чого:
Ea = -mR
Тут ми знаємо, що значення m і R є константою, що дорівнює 8,314 Дж / К · моль.
Як впливає енергія активації на швидкість реакції?
При спробі скласти зображення енергії активації, вона може розглядатися як бар'єр, який не дозволяє протікати реакції між молекулами нижчої енергії.
Оскільки в загальній реакції буває, що кількість молекул, які можуть реагувати, досить велика, швидкість - і еквівалентно - кінетична енергія цих молекул - може бути дуже змінною..
Зазвичай трапляється, що лише невелика кількість сукупності молекул, які зазнають зіткнення - ті, що мають більшу швидкість руху - представляють достатню кінетичну енергію, щоб мати можливість подолати величину енергії активації. Таким чином, ці молекули здатні і можуть бути частиною реакції.
Згідно з рівнянням Арреніуса, негативний знак - який передує частковому відношенню енергії активації і добутку газової постійної за абсолютною температурою - означає, що постійна швидкості зменшується при збільшенні енергії активації, а також зростання при підвищенні температури.
Приклади розрахунку енергії активації
Для обчислення енергії активації шляхом побудови графіка, згідно рівняння Арреніуса, ми маємо, що константи швидкості реакції розкладання ацетальдегіду були виміряні при п'яти різних температурах, і ми хочемо визначити енергію активації. для реакції, яка виражається як:
CH3CHO (g) → CH4(g) + CO (g)
Дані п'яти вимірювань такі:
k (1 / M1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
По-перше, для вирішення цього невідомого і визначення енергії активації необхідно побудувати графік ln k vs 1 / T (y vs x), щоб отримати пряму лінію, а звідси взяти схил і знайти значення Ea, як пояснено.
Перетворюючи дані вимірювань, згідно з рівнянням Арреніуса [ln k = (- Ea / R) (1 / T) + ln A] для y та x знайдено наступні значення:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
З цих значень і за допомогою математичного розрахунку нахилу - або в комп'ютері, або в калькуляторі, за допомогою виразу m = (Y)2-Y1) / (X2-X1) або з використанням методу лінійної регресії - отримаємо, що m = -Ea / R = -2.09 * 104 К. Так:
Ea = (8,314 Дж / К · моль) (2,09 * 10)4 K)
= 1,74 * 105 = 1,74 * 102 кДж / моль
Для визначення інших енергій активації за допомогою графічного способу проводиться аналогічна процедура.
Список літератури
- Вікіпедія. (s.f.). Енергія активації. Отримано з en.wikipedia.org
- Chang, R. (2007). Хімія, дев'яте видання. Мексика: McGraw-Hill.
- Britannica, E. (s.f.). Енергія активації. Отримано з britannica.com
- Moore, J. W. і Pearson, Р. G. (1961). Кінетика і механізм. Отримано з books.google.co.ve
- Kaesche, H. (2003). Корозія металів: фізико-хімічні принципи та сучасні проблеми. Отримано з books.google.co.ve


