Властивості натрію гідриду (NaH), реакційна здатність, небезпеки та застосування
The гідрид натрію являє собою неорганічне з'єднання формули NaH. Він має іонний зв'язок між натрієм і гідридом. Його структура проілюстрована на малюнку 1. Вона є репрезентативною для сольових гідридів, що означає, що він є гідридом, подібним до солі, що складається з іонів Na + та H-, на відміну від більш молекулярних гідридів, таких як боран, метан, аміак. і води.
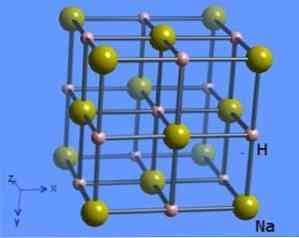
Кристалічна структура має координаційне число 6, де кожна молекула натрію оточена 8 гідридними іонами, що мають восьмигранну форму і проілюстрована на фіг.2 (Mark Winter [Університет Шеффілда і WebElements Ltd, 1993-2016).
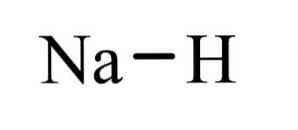
З'єднання готують шляхом прямої реакції між натрієм і водневим газом (Формула гідриду натрію - Використання, властивості, структура і формула натрію гідриду, 2005-2017) наступним чином:
H2 + 2Na → 2NaH
Гідрид натрію продається комерційно у вигляді 60% w / w дисперсійної форми (ваговий відсоток) у мінеральному маслі для безпечного поводження (SODIUM HYDRIDE, s.f.).
Індекс
- 1 Фізико-хімічні властивості гідриду натрію
- 2 Реактивність і небезпека
- 3 Використання
- 4 Посилання
Фізико-хімічні властивості гідриду натрію
Гідрид натрію є білим твердим речовиною, коли він є чистим, хоча його зазвичай отримують сірим або срібним. Його вигляд показаний на фіг.3.

NaH має молекулярну масу 23,99771 г / моль, щільність 1,396 г / мл і температуру плавлення 800 ° C (Royal Society of Chemistry, 2015). Нерозчинний у аміаку, бензолі, чотирихлористому вуглецю та сірковуглецю (Національний центр біотехнологічної інформації, ср.).
З'єднання надзвичайно нестійке. Чистий NaH може легко запалюватися в повітрі. Коли вона вступає в контакт з водою, що присутня в повітрі, вона вивільняє легкозаймистий водень.
У відкритому повітря і вологи NaH також легко гідролізується в сильну корозійну основу гідроксиду натрію (NaOH) відповідно до реакції:
NaH + H2O → NaOH + H2
У цій реакції можна спостерігати, що гідрид натрію веде себе як основа. Це пов'язано з електронегативністю.
Натрій має значно нижчу електронегативність (≈1.0), ніж водень (≈2.1), що означає, що водень витягує електронну щільність до себе, віддаляючись від натрію, щоб генерувати катіон натрію і аніон. гідриду.
Для того, щоб сполука була кислотою Бренстеда, вона повинна відокремити електронну щільність від водню, тобто з'єднати його з електронегативним атомом, таким як кисень, фтор, азот тощо. Тільки тоді його можна офіційно назвати H + і може бути дисоційованим як такий.
Гідрид набагато краще описаний як H- і має вільну пару електронів. Таким чином, це база Бренстеда, а не кислота. Насправді, якщо ви розширюєте визначення кислоти / основи Бренстеда так, як це зробив Льюїс, то прийдете до висновку, що натрій (Na +) є кислотним видом тут.
Продукт реакції кислоти / основи Бренстеда H-основи і H + кислоти стає H2. Оскільки кислий водень витягується безпосередньо з води, газоподібний водень може міхура, витісняючи рівновагу, навіть якщо реакція не є термодинамічно сприятливою.
Іони OH- можуть бути залишені, які можна записати з рештою катіона Na +, щоб отримати гідроксид натрію (Чому твердий гідрид натрію, а не кислота при реакції з водою?, 2016).
Реактивність і небезпека
З'єднання є потужним відновником. Атакує SiO2 у склі. Вона запалюється при контакті з газоподібними F2, Cl2, Br2 і I2 (останній при температурах вище 100 ° C), особливо в присутності вологи, для утворення HF, HCl, HBr і HI.
Реагує з сіркою, даючи Na2S і H2S. Він може вибухово реагувати з диметилсульфоксидом. Реагує енергійно з ацетиленом навіть при температурі -60 ° С..
Вона ініціює реакцію полімеризації в етил-2,2,3-трифторпропионате, так що складний ефір розкладається сильно. Присутність в реакції діетилсукцинату і трифторацетату викликало вибухи (SODIUM HYDRIDE, 2016).
Гідрид натрію вважається корозійним для шкіри або очей, внаслідок потенціалу їдких побічних продуктів реакцій з водою.
У разі контакту з очима, їх слід промити великою кількістю води, під повіками протягом принаймні 15 хвилин і негайно звернутися до лікаря..
У разі контакту з шкірою негайно протріть і промийте уражену ділянку водою. Зверніться за медичною допомогою, якщо роздратування зберігається.
Це шкідливо при попаданні всередину внаслідок реакції на воду. Не викликати блювоту. Ви повинні негайно звернутися до лікаря і перевести потерпілого в медичний центр.
Дисперсія гідриду натрію в маслі не є пилом. Однак матеріал, який реагує, може виділяти тонкий каустичний туман. При вдиханні полоскати рот водою і перевести потерпілого на місце зі свіжим повітрям. Необхідно шукати медичну допомогу (Rhom and Hass Inc., 2007).
Використання
Основним застосуванням гідриду натрію є проведення реакцій конденсації і алкілування, які розвиваються через утворення карбаніона (каталізується основою).
Гідрид натрію в нафті нагадує алкоголяти натрію і металів натрію, у його здатності функціонувати як депротонирующий агент в ацетоуксусному ефірі, Claisen, Stobbe, Dieckmann та інших споріднених реакціях. Це має помітні переваги перед іншими конденсаторами в тому, що:
- Це сильніша основа, що призводить до більш прямого депротонування.
- Ніякого надлишку не потрібно.
- Отриманий H2 дає міру ступеня реакції.
- Вторинні реакції, такі як скорочення, усуваються.
Алкілування ароматичних і гетероциклічних амінів, таких як 2-амінопіридин і фенотіазин, легко досягаються при високому виході з використанням сумішей толуол-метилформамід. Концентрація диметилформамідів є змінною, що використовується для контролю швидкості реакції (HINCKLEY, 1957).
Запропоновано використання гідриду натрію для зберігання водню для використання в транспортних засобах з паливними елементами, при цьому гідрид укладається в пластмасові гранули, які подрібнюються в присутності води для вивільнення водню.
Список літератури
- HINCKLEY, М. D. (1957). Виробництво, обробка та використання гідриду натрію. Досягнення в хімії, т. 19, 106-117.
- Марк Зима [Університет Шеффілд і ВебЕлементс Лтд, У. (1993-2016). Натрій: гідрид натрію. Отримано з WebElements: webelements.com.
- Національний центр біотехнологічної інформації. (s.f.). База даних PubChem Compound; CID = 24758. Отримано з PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom і Hass вкл. (2007, грудень). Натрію гідрид 60% дисперсії в олії. Отримано з dow.com.
- Королівське хімічне товариство. (2015). Гідрид натрію. Отримано з ChemSpider: chemspider.com.
- НАТРІЙ ГИДРИД. (2016). Отримано з cameochemicals: cameochemicals.noaa.gov.
- Формула гідриду натрію - гідрид натрію, його властивості, структура та формула. (2005-2017). Отримано з Softschools.com: softschools.com.
- НАТРІЙ ГИДРИД. (s.f.). Отримано з хімічноїпальми21: chemicalland21.com.
- Чому твердий гідрид натрію, а не кислота при взаємодії з водою? (2016, 20 квітня). Отримано з stackexchange: chemistry.stackexchange.com.


