Атомний радіус, як він вимірюється, як він змінюється в періодичній таблиці, приклади
The атомний радіус це важливий параметр для періодичних властивостей елементів періодичної таблиці. Вона безпосередньо пов'язана з розміром атомів, оскільки при більшому радіусі більші або великі є. Так само, це пов'язано з електронними характеристиками того ж самого.
Поки атом має більше електронів, тим більше його розмір і атомний радіус. Обидва визначаються електронами валентної оболонки, оскільки на відстанях за їх орбітами ймовірність знаходження електрона наближається до нуля. У околі ядра відбувається протилежне: вірогідність знаходження електрона зростає.

Верхнє зображення являє собою упаковку ватяних кульок. Зауважте, що кожен з них оточений шістьма сусідами, не рахуючи іншого можливого верхнього або нижнього рядка. Спосіб ущільнення ватних кульок визначатиме їх розміри і, отже, їх радіуси; так само, як це відбувається з атомами.
Елементи за своєю хімічною природою так чи інакше взаємодіють зі своїми атомами. Отже, величина атомного радіусу змінюється залежно від типу присутніх зв'язків і твердої упаковки його атомів.
Індекс
- 1 Як вимірюється атомний радіус?
- 1.1 Визначення міжядерної відстані
- 1.2 Одиниці
- 2 Як це змінюється в періодичній таблиці?
- 2.1 Протягом періоду
- 2.2 Спускаючись групою
- 2.3 Скорочення лантанідів
- 3 Приклади
- 4 Посилання
Як вимірюється атомний радіус?
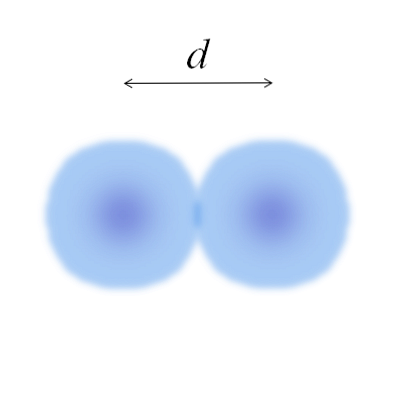
В основному зображенні можна легко виміряти діаметр ватних кульок, а потім розділити його на два. Однак сфера атома не повністю визначена. Чому? Оскільки електрони циркулюють і дифундують в конкретних областях простору: орбіталі.
Тому атом можна розглядати як сферу з нерозрізними ребрами, про яку неможливо сказати напевно, наскільки вони закінчуються. Наприклад, у верхньому зображенні центральна область, поблизу ядра, виглядає більш інтенсивним кольором, а її краї розмиті..
Зображення являє собою двоатомну молекулу Е2 (як Cl2, H2, O2, тощо). Припускаючи, що атоми є сферичними тілами, якщо відстань були визначені d що відокремлює обидва ядра в ковалентном зв'язку, тоді достатньо буде поділити його на дві половини (d/ 2) для отримання атомного радіуса; точніше, ковалентний радіус Е для Е2.
А якщо E не утворює ковалентні зв'язки з собою, а це металевий елемент? Потім d це буде позначено числом сусідів, які оточують Е в його металевій структурі; тобто за координаційним числом (N.C) атома в упаковці (запам'ятайте ватні кульки головного зображення).
Визначення міжядерної відстані
Для визначення d, яка є міжядерною відстанню для двох атомів в молекулі або упаковці, вона вимагає фізичних методів аналізу.
Одним з найбільш часто використовуваних рентгенівських дифракцій є промінь світла, що опромінюється через кристал, і досліджується дифракційна картина, що виникає в результаті взаємодії електронів і електромагнітного випромінювання. В залежності від упаковки можуть бути отримані різні дифракційні структури і, отже, інші значення d.
Якщо атоми "щільно" в кристалічній решітці, то вони будуть представляти різні значення d у порівнянні з тим, що вони мали б, якби вони були "зручними". Крім того, ці міжядерні відстані можуть коливатися в значеннях, тому атомний радіус фактично складається з середнього значення таких вимірювань.
Як пов'язаний атомний радіус і координаційний номер? В. Гольдшмідт встановив зв'язок між цими двома, у яких для NС 12, відносне значення дорівнює 1; від 0,97 для упаковки, де атом має NC, що дорівнює 8; 0,96, для N.C - 6; і 0,88 для NC 4.
Одиниці
З значень для N.C, рівних 12, побудовано багато таблиць, які порівнюють радіуси атомів усіх елементів періодичної таблиці.
Оскільки не всі елементи утворюють такі компактні структури (N.С менше 12), взаємозв'язок В. Гольдшмідт використовується для розрахунку їх атомних радіусів і вираження їх для однієї упаковки. Таким чином, вимірювання атомних радіусів стандартизовані.
Але в яких одиницях вони виражають себе? З d має дуже малу величину, слід звернутися до блоків ангстрему Å (10 ∙ 10)-10м) або також широко застосовується пікометр (10. 10-12м).
Як це змінюється в періодичній таблиці?
Протягом усього періоду
Атомні радіуси, визначені для металевих елементів, дають назву металевих радіусів, а для неметалевих елементів - ковалентні радіуси (фосфор, Р4, або сірка, S8). Однак, між обома типами радіостанцій існує більш помітна відмінність, ніж назва.
Зліва направо в той же період ядро додає протони і електрони, але останнє обмежується одним і тим же рівнем енергії (основним квантовим числом). Як наслідок, ядро збільшує ефективний ядерний заряд на валентних електронах, які стикаються з атомним радіусом.
Таким чином, неметалеві елементи в той же період мають тенденцію мати атомні (ковалентні) радіуси менше, ніж метали (металеві радіуси).
Спускаючись групою
При спуску групою, нові рівні енергії включаються, що дозволяє електронам мати більше простору. Таким чином, електронне хмара охоплює великі відстані, розмиті периферії закінчуються тим, що більше віддаляється від ядра, а отже, атомний радіус розширюється.
Скорочення лантаноїдів
Електрони внутрішнього шару допомагають захистити ефективний ядерний заряд від валентних електронів. Коли орбіталі, що складають внутрішні шари, мають багато "дірок" (вузлів), як і з орбіталями f, ядро сильно стикається з атомним радіусом через поганий захисний ефект орбіталей..
Цей факт підтверджується скороченням лантаноида в періоді 6 періодичної таблиці. Від La до Hf спостерігається значне скорочення атомного радіуса, створюваного орбіталями f, які "заповнюються", проходячи через блок f: у лантаноїдів і актиноидов.
Аналогічний ефект також може спостерігатися з елементами блоку p з періоду 4. Цей момент часу продукт слабкого екрануючого ефекту орбіталей d, що заповнюється при перетині періодів перехідних металів..
Приклади
Для періоду 2 періодичної таблиці атомні радіуси її елементів:
-Li: 257 вечора
-Бути: 112 вечора
-B: 88 вечора
-C: 77 pm
-N: 74 pm
-O: 66 вечора
-F: 64 стор.
Зазначимо, що метал літію має найбільший атомний радіус (257 p.m.), у той час як фтор, розташований у крайньому правому куті періоду, є найменшим з них (64 години). Атомний радіус опускається зліва направо в той же період, і перераховані значення показують його.
Літій, утворюючи металеві зв'язки, його радіус є металевим; і фтор, оскільки він утворює ковалентні зв'язки (F-F), його радіус є ковалентним.
А якщо ви хочете висловити атомні радіостанції в одиницях ангстрему? Просто поділіть їх на 100: (257/100) = 2.57Å. І так далі з іншими цінностями.
Список літератури
- Хімія 301. Атомна радіі. Отримано з: ch301.cm.utexas.edu
- Фонд СК-12. (28 червня 2016 року). Атомний радіус. Отримано з: chem.libretexts.org
- Тенденції в атомній радіі. Взяті з: intro.chem.okstate.edu
- Clackamas Community College. (2002). Атомний розмір. Отримано з: dl.clackamas.edu
- Кларк Дж. (Серпень 2012). Атомний і іонний радіус. Отримано з: chemguide.co.uk
- Shiver & Atkins. (2008). Неорганічна хімія (Четверте видання., Стор. 23, 24, 80, 169). Mc Graw Hill.


