Реакція омилення та речовини, які можуть бути отримані
The омилення Це основний гідроліз складного ефіру. Це означає, що складний ефір взаємодіє з підставою (NaOH або KOH) необоротно, виробляючи спирт і карбоксилати натрію або калію. Слово означає "виробництво мила" і, по суті, є однією з найдавніших хімічних реакцій, використовуваних людством.
У вавілонські часи, за допомогою попелу, зібраного з деревини, рослин і тваринних жирів, вони вдосконалили мистецтво виготовлення мила. Чому тваринний жир? Причина в тому, що вона багата гліцериновими трістерами (тригліцеридами), а деревний зола є джерелом калію, основного металу.
В іншому випадку реакція протікає до більш низького виходу, але достатньо, щоб відобразити його вплив на фарби і деякі поверхні. Це стосується масляних картин, де пігменти змішуються з маслом (джерело ефірів).
Індекс
- 1 Реакція омилення
- 1.1 Механізм
- 1.2 Кінетика
- 2 Речовини, які можуть бути отримані омиленням
- 2.1 Розчинник дії мила
- 3 Посилання
Реакція омилення
Механізм
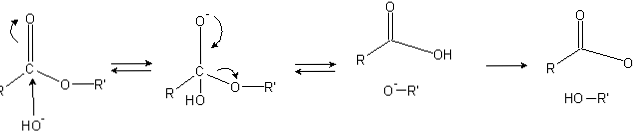
Ефіри мають ацильную групу (O = C-R), яка сприйнятлива до нуклеофільних нападів, таких як OH-.
Оскільки атоми кисню "крадуть" електронну щільність від атома вуглецю, вона частково заряджена, тим більше в разі ефірів.
Отже, цей позитивний заряд притягує негативні види, здатні подавати електрони до атома вуглецю, при цьому відбувається нуклеофільна атака (ліва сторона зображення). В результаті утворюється тетраедричний проміжний (друга молекула зліва направо).
Негативний заряд на кисень тетраедричного проміжного продукту є продуктом OH- оточуючих Потім цей негативний заряд ділокалізують, щоб створити карбонільну групу, "змушуючи" потім розірвати зв'язок C-OR. Також це переміщення продукує карбонову кислоту RCOOH і алкоксидний іон R'O-.
Нарешті, оскільки реакційне середовище є основним, алкоксид депротонирует одну молекулу води і карбонову кислоту реагує з іншою ОН- середовища, генеруючи продукти омилення.
Кінетика
Швидкість реакції омилення пропорційна концентраціям реагентів. Іншими словами, збільшуючи або концентрацію складного ефіру (RCOOR '), або основу (NaOH), реакція буде протікати більш високою швидкістю.
Це також перекладається наступним чином: швидкість омилення є першим порядком по відношенню до складного ефіру, і перший порядок по відношенню до бази. Вищезгадане можна виразити наступним математичним рівнянням:
Швидкість = k [RCOOR '] [NaOH]
Де k - константа або коефіцієнт швидкості, який змінюється як функція температури або тиску; тобто, чим вище тепло, тим більше швидкість омилення. З цієї причини середовище піддається кип'ятінню.
Оскільки обидва реагенти є кінетичними першого порядку, загальна реакція є другим порядком.
У механізмі реакції сапоніфікації утворення тетраедричного проміжного з'єднання вимагає нуклеофільної атаки, яка включає як ефір, так і основу.
Таким чином, кінетика другого порядку відображається в цьому факті, оскільки вони втручаються в (повільний) детермінантний крок реакції.
Речовини, які можуть бути отримані омиленням

Основними продуктами омилення є спирти і солі карбонових кислот. У кислому середовищі отримують відповідні RCOOH, отримані омиленням жирів і олій, які відомі як жирні кислоти..
Таким чином, мило складається з солей жирних кислот, що утворюються в результаті омилення. Ви виходите з якими катіонами? Вони можуть бути Na+, K+, Mg2+, Віра3+, і т.д..
Ці солі розчиняються у воді, але осаджується дією NaCl, що додається до суміші, яка зневоднює мило і відокремлює його від водної фази. Реакція омилення тригліцериду полягає в наступному:
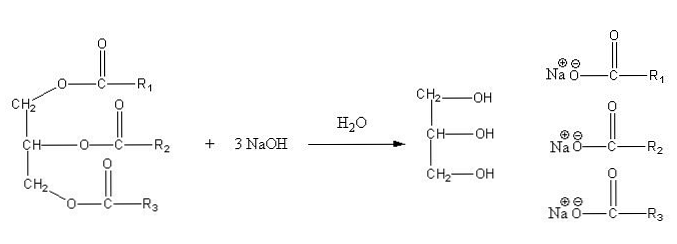
Гліцерин є спиртовим "Е", а милом є всі солі одержуваних жирних кислот. Тут кожна бічна ланцюг -R має різну довжину і ступінь ненасиченості. Отже, ці ланцюги роблять різницю між жирами і рослинними маслами.
Ключ до виробництва мила потім полягає у виборі кращих жирів і масел, а точніше, у виборі різних джерел тригліцеридів.
Ця біла мильна маса може містити у своїй структурі барвники та інші органічні сполуки, що надає йому приємні аромати та яскраві кольори. Звідси різноманітність можливостей приручена мистецтвом і покликанням у цій торгівлі.
Однак реакція омилення також є синтетичним шляхом карбонових кислот і спиртів, які не обов'язково мають стосуватися гліцерину або мила.
Наприклад, основний гідроліз будь-якого ефіру, такого як простий етилацетат, буде продукувати оцтову кислоту і етанол.
Розчинник дії мила

Солі жирних кислот розчиняються у воді, але не так, як іони сольватировани; тобто в оточенні водної сфери. У випадку мила їх бічні ланцюги -R запобігають їх теоретичному розчиненню у воді.
Тому, щоб протидіяти цьому енергетично незручному положенню, вони орієнтовані таким чином, що ці ланцюги стикаються, утворюючи аполярне органічне ядро, а полярні голови - кінець (-СОО)- Na+), взаємодіють з молекулами води і створюють "полярну оболонку".
Вищенаведене ілюструється на зображенні вище, де показаний цей тип структури, відомий як міцела.
"Чорні хвости" відповідають гідрофобним ланцюгам, що заплутуються в органічному ядрі, захищеному сірими сферами. Ці сірі сфери складають полярний щит, головки -СОО- Na+.
Потім міцели є кластерами (кластерами) солей жирних кислот. У них вони можуть укласти жир, який нерозчинний у воді через його аполярний характер.
Як вони це роблять? Як жирові, так і -R-ланцюги є гідрофобними, тому обидва мають велику спорідненість один до одного.
Коли міцели укладають жири, вода взаємодіє з полярною оболонкою, дозволяючи розчинність мила. Аналогічно, міцели негативно заряджаються, викликаючи відштовхування один одному і, отже, генеруючи дисперсію жиру.
Список літератури
- Anne Marie Helmenstine, Ph.D. (3 жовтня 2017 року). Визначення сапонізації та реакція. Отримано 24 квітня 2018 року з: thoughtco.com
- Френсіс А. Кері. Органічна хімія Карбонові кислоти. (шосте видання., стор. 863-866). Mc Graw Hill.
- Грем Соломонс Т.В., Крейг Б. Фріле. Органічна хімія. Ліпіди (10-е видання., Стор. 1056-1058). Wiley Plus.
- Вікіпедія. (2018). Омилення. Отримано 24 квітня 2018 року з: en.wikipedia.org
- Бойд К. (27 лютого 2015 р.). Розумійте хімію та історію мила. Отримано 24 квітня 2018 року від: chemservice.com
- Лука Лагі (27 березня 2007 року). Омилення. Отримано 24 квітня 2018 року з: commons.wikimedia.org
- Amanda Crochet (12 травня 2015 року). Micelle (відтінки сірого). Отримано 24 квітня 2018 року з: commons.wikimedia.org


