Кетогенез типів кетонових тіл, синтез і деградація
The кетогенез є процесом, за допомогою якого отримують ацетоацетат, β-гідроксибутират і ацетон, які разом називаються кетоновими тілами. Цей складний і тонко регульований механізм здійснюється в мітохондріях, від катаболізму жирних кислот.
Отримання кетонових тіл відбувається тоді, коли організм піддається вичерпним періодам голодування. Хоча ці метаболіти синтезуються в основному в клітинах печінки, вони виявляються як важливе джерело енергії в різних тканинах, таких як скелетні м'язи і тканини серця і мозку..
Hydroxy-гідроксибутират і ацетоацетат є метаболітами, що використовуються як субстрати в серцевому м'язі і корі головного мозку. У мозку кетонові тіла стають важливими джерелами енергії, коли організм вичерпав свій запас глюкози.
Індекс
- 1 Загальна характеристика
- 2 Типи і властивості кетонових тіл
- 3 Синтез кетонових тіл
- 3.1 Умови для кетогенезу
- 3.2 Механізм
- 3.3 β-окислення і кетогенез пов'язані між собою
- 3.4 Регулювання β-окислення та його вплив на кетогенез
- 4 Деградація
- 5 Медична актуальність кетонових тіл
- 5.1 Цукровий діабет і накопичення кетонових тіл
- 6 Посилання
Загальна характеристика
Кетогенез вважається дуже важливою фізіологічною функцією або метаболічним шляхом. Як правило, цей механізм здійснюється в печінці, хоча було показано, що воно може бути проведено в інших тканинах, здатних метаболізувати жирні кислоти..
Утворення кетонових тіл є основним метаболічним похідним ацетил-КоА. Цей метаболіт отримують з метаболічного шляху, відомого як β-окислення, що є деградацією жирних кислот..
Наявність глюкози в тканинах, де відбувається β-окислення, визначає метаболічну долю ацетил-КоА. У конкретних ситуаціях окислені жирні кислоти практично повністю спрямовані на синтез кетонових тіл.
Типи і властивості кетонових тіл
Основним кетоновим тілом є ацетоацетат або ацетоуксусная кислота, яка синтезується в основному в клітинах печінки. Інші молекули, що входять до складу кетонових тіл, походять від ацетоацетату.
Зниження ацетооцтової кислоти призводить до D-β-гідроксибутирату, другого тіла кетону. Ацетон є сполукою, яку важко розкласти і виробляється спонтанною реакцією декарбоксилювання ацетоацетату (тому він не вимагає втручання будь-якого ферменту), коли він присутній у високій концентрації в крові.
Позначення кетонових тіл було організовано за згодою, оскільки строго кажучи, β-гідроксибутират не має кетонової функції. Ці три молекули розчинні у воді, що полегшує їх транспортування в кров. Його основна функція полягає в тому, щоб забезпечити енергію певним тканинам, таким як скелетний і серцевий м'яз.
Ферменти, що беруть участь в утворенні кетонових тіл, знаходяться в основному в клітинах печінки і нирок, що пояснює, чому ці два місця є основними виробниками цих метаболітів. Його синтез відбувається тільки і виключно в мітохондріальній матриці клітин.
Як тільки ці молекули синтезуються, вони йдуть в кров і йдуть до тканин, які потребують їх, де вони деградують до ацетил-КоА.
Синтез кетонових тіл
Умови для кетогенезу
Метаболічна доля ацетил-КоА від β-окислення залежить від метаболічних потреб організму. Це окислюється до CO2 і Н2Або через цикл лимонної кислоти або синтез жирних кислот, якщо метаболізм ліпідів і вуглеводів стабільний в організмі.
Коли організм потребує утворення вуглеводів, оксалоацетат використовується для виробництва глюкози (глюконеогенезу) замість початку циклу лимонної кислоти. Це відбувається, як згадано, коли організм має деяку нездатність отримати глюкозу, у випадках, таких як тривале голодування або наявність діабету.
Завдяки цьому ацетил-КоА, що утворюється в результаті окислення жирних кислот, використовується для виробництва кетонових тіл.
Механізм
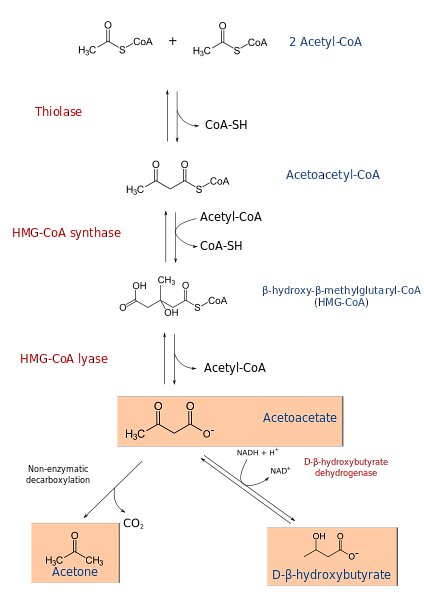
Процес кетогенезу починається з продуктів β-окислення: ацетацетил-КоА або ацетил-КоА. Коли субстрат є ацетил-КоА, перший етап включає конденсацію двох молекул, реакцію, катализируемую ацетил-КоА-трансферазою, з отриманням ацетацетил-КоА.
Ацетацетил-КоА конденсується з третім ацетил-КоА дією синтази HMG-CoA з отриманням HMG-CoA (β-гідрокси-β-метилглутарил-CoA). HMG-CoA розкладається на ацетоацетат і ацетил-CoA за допомогою дії HMG-CoA ліази. Таким чином отримують перше кетоновое тіло.
Ацетоацетат знижується до β-гідроксибутирату шляхом втручання β-гідроксибутиратдегідрогенази. Ця реакція залежить від NADH.
Основним ацетоацетатним кетоновим тілом є β-кетова кислота, яка зазнає неферментативне декарбоксилювання. Цей процес простий і виробляє ацетон і СО2.
Таким чином, ця серія реакцій призводить до появи кетонових тіл. Ці речовини, що розчиняються у воді, можуть легко транспортуватися через кров, без необхідності прив'язуватися до структури альбуміну, як у випадку з жирними кислотами, нерозчинними у водному середовищі..
.-Окислення і кетогенез пов'язані
Метаболізм жирних кислот продукує субстрати для кетогенезу, тому ці два шляхи функціонально пов'язані.
Ацетоацетил-КоА є інгібітором обміну жирних кислот, оскільки припиняє активність дегідрогенази ацил-КоА, яка є першим ферментом β-окислення. Крім того, він також інгібує ацетил-CoA-трансферазу і синтазу HMG-CoA.
Фермент HMG-CoA-синтаза, підпорядкований CPT-I (фермент, що бере участь у виробництві ацил-карнітину в β-окисленні), представляє важливу регуляторну роль у формуванні жирних кислот..
Регулювання β-окислення та його вплив на кетогенез
Годівля організмів регулює складний набір гормональних сигналів. Вуглеводи, амінокислоти і ліпіди, що споживаються в раціоні, осідають у вигляді триацилглицеринов в жировій тканині. Інсулін, анаболічний гормон, бере участь у синтезі ліпідів і утворенні триацилгліцеролів.
На мітохондріальному рівні β-окислення контролюється надходженням і участю деяких субстратів в мітохондріях. Фермент CPT I синтезує ацил-карнітин з цитозольного Acyl CoA.
Коли організм годується, активується карбоксилаза ацетил-СоА і цитрат підвищує рівні СРТ I, а його фосфорилювання зменшується (циклічна АМФ-залежна реакція).
Це викликає накопичення малонила СоА, що стимулює синтез жирних кислот і блокує їх окислення, запобігаючи генеруванню безплідного циклу..
У разі голодування активність карбоксилази є дуже низькою, оскільки рівні ферменту СРТ I були знижені, і вони були фосфорильовані, активуючи і сприяючи окислення ліпідів, що пізніше дозволить утворення кетонових тіл через ацетил-КоА.
Деградація
Кетонові тіла дифундують з клітин, де їх синтезують і транспортують до периферичних тканин кров'ю. У цих тканинах вони можуть бути окислені за допомогою циклу трикарбонових кислот.
У периферичних тканинах β-гідроксибутират окислюється до ацетоацетату. Згодом даний ацетоацетат активується ферментом 3-кетоацил-CoA трансферазой.
Сукцинил-CoA діє як донор CoA, який стає сукцинатом. Активація ацетоацетату відбувається для запобігання сукцинату CoA ставати сукцинатом у циклі лимонної кислоти, причому пов'язаний синтез GTP дією сукциніл-CoA синтази.
Отриманий ацетоацетил-КоА піддається тиолитическому розщепленню, що продукує дві молекули ацетил-КоА, які включені в цикл трикарбонової кислоти, більш відомий як цикл Кребса..
У клітинах печінки відсутня 3-кетоацил-КоА-трансфераза, що перешкоджає активації цього метаболіту в цих клітинах. Таким чином гарантується, що кетонові тіла не окислюються в клітинах, де вони були вироблені, але вони можуть бути передані в тканини, де потрібна їх активність..
Медична актуальність кетонових тіл
У людському організмі високі концентрації кетонових тіл в крові можуть викликати особливі умови, які називаються ацидозом і кетонемією.
Виготовлення цих метаболітів відповідає катаболізму жирних кислот і вуглеводів. Однією з найпоширеніших причин патологічного стану кетогенезу є висока концентрація оцтових фрагментів дикарбонату, які не розкладаються шляхом трікарбонової кислоти..
Як наслідок, спостерігається збільшення рівнів кетонових тіл у крові вище від 2 до 4 мг / 100 N і їх присутності в сечі. Це призводить до порушення проміжного метаболізму зазначених метаболітів.
Деякі дефекти нейрогландулярних гіпофізарних факторів, що регулюють деградацію і синтез кетонових тіл, разом з порушеннями в метаболізмі вуглеводнів, є причиною стану гіперцетонемії.
Цукровий діабет і накопичення кетонових тіл
Цукровий діабет (тип 1) є ендокринним захворюванням, що викликає збільшення виробництва кетонових тіл. Недостатнє виробництво інсуліну відключає транспортування глюкози до м'язів, печінки і жирової тканини, таким чином накопичуючись в крові.
Клітини при відсутності глюкози починають процес глюконеогенезу і деградації жирів і білків для відновлення їх метаболізму. Як наслідок, концентрація оксалоацетату знижується, а окислення ліпідів зростає.
Потім відбувається накопичення ацетил-КоА, який у відсутності оксалоацетату не може слідувати шляху лимонної кислоти, викликаючи високу продукцію кетонових тіл, характерних для цього захворювання..
Накопичення ацетону виявляється його наявністю в сечі і диханні людей, які мають це стан, і є насправді одним з симптомів, які вказують на прояв цього захворювання..
Список літератури
- Blázquez Ortiz, C. (2004). Кетогенез в астроцитах: характеристика, регулювання та можлива цитопротекторна роль (Докторська дисертація, Universidad Complutense de Madrid, Служба публікацій).
- Девлін, Т. М. (1992). Підручник з біохімії: з клінічними кореляціями.
- Garrett, R. H., & Grisham, C. M. (2008). Біохімія. Томсон Брукс / Коул.
- McGarry, J.D., Mannaerts, G.P., & Foster, D.W. (1977). Можлива роль малоніл-КоА в регуляції окислення печінкових жирних кислот і кетогенезу. Журнал клінічного дослідження, 60(1), 265-270.
- Мело, В., Руїс, В. М., і Куамати, О. (2007). Біохімія метаболічних процесів. Реверте.
- Nelson, D.L., Lehninger, A.L., & Cox, M.M. (2008). Принципи біохімії Лінгенера. Макміллан.
- Pertierra, A.G., Gutiérrez, C. V., & Other, C.M. (2000). Основи метаболічної біохімії. Редакція Тебар.
- Voet, D., & Voet, J.G. (2006). Біохімія. Ed. Panamericana Medical.


