Типи, властивості, номенклатура, використання і приклади кетонів
The кетони вони є органічними сполуками, які мають карбонільну групу (-CO). Вони являють собою прості сполуки, в яких вуглець карбонільної групи пов'язаний з двома атомами вуглецю (та їх ланцюгами-заступниками). Кетони є "простими", тому що вони не мають реакційних груп, таких як -OH або -Cl, приєднані до вуглецю.
Нарешті, ліквідація кетонів з організму людини зазвичай пов'язана з низьким рівнем цукру (при діабетичних випадках та / або екстремальному голодуванні), що може викликати серйозні проблеми зі здоров'ям пацієнта..
Індекс
- 1 Загальна формула кетонів
- 2 Види кетонів
- 2.1 За структурою вашого ланцюга
- 2.2 Відповідно до симетрії її радикалів
- 2.3 За насиченням її радикалів
- 2.4 Дикетони
- 3 Фізико-хімічні властивості кетонів
- 3.1 Температура кипіння
- 3.2 Розчинність
- 3.3 Кислотність
- 3.4 Реактивність
- 4 Номенклатура
- 5 Різниця між альдегідами та кетонами
- 6 Використання промислового та повсякденного життя
- 7 Приклади кетонів
- 7.1 Бутанон (C4H8O)
- 7.2 Циклогексанон (C6H10O)
- 7.3 Тестостерон (C19H22O2)
- 7.4 Прогестерон (C21H30O2)
- 8 Посилання
Загальна формула кетонів
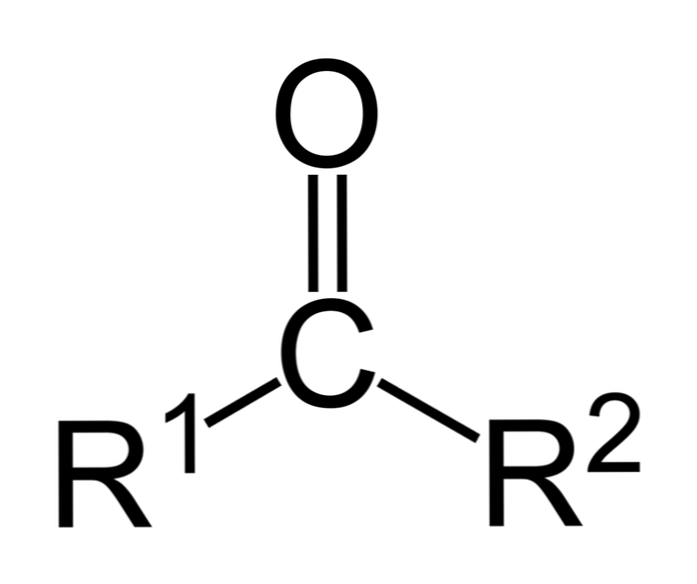
Кетони являють собою карбонільні сполуки, в яких ця група пов'язана з двома вуглеводневими групами; це можуть бути алкільні групи, бензольні кільцеві групи або обидва.
Кетон може бути просто представлений як R- (C = O) -R ', де R і R' - будь-які дві вуглеводневі ланцюги (алкани, алкени, алкіни, циклоалкани, похідні бензолу та інші). Немає кетонів з воднем, приєднаним до карбонільної групи.
Існує широкий спектр способів приготування кетонів в промисловому та лабораторному середовищі; Крім того, важливо відзначити, що кетони можуть бути синтезовані різними організмами, включаючи людину.
У промисловості найбільш поширеним способом синтезу кетонів є окислення вуглеводнів, як правило, з використанням повітря. У малих масштабах кетони зазвичай готують шляхом окислення вторинних спиртів, що дає в якості продуктів кетон і воду.
Крім цих найбільш поширених методів, кетони можуть бути синтезовані за допомогою алкенів, алкінів, солей сполук азоту, складних ефірів і багатьох інших сполук, що дозволяє легко їх отримувати.
Види кетонів
Існує кілька класифікацій для кетонів, що залежать головним чином від заступників у їхніх ланцюгах R. Нижче наведені найбільш поширені класифікації цих речовин:
Відповідно до структури вашого ланцюжка
У цьому випадку кетон класифікується за способом, в якому його структурований ланцюг: аліфатичні кетони є такими, які мають два радикали R і R ', які мають форму алкільних радикалів (алканів, алкенів, алкинов і циклоалканов)..
Зі свого боку, ароматичні речовини є такими, що утворюють похідні бензолу, при цьому вони все ще є кетонами. Нарешті, змішані кетони являють собою ті, які мають R алкильний радикал і R 'арильний радикал, або навпаки.
Відповідно до симетрії її радикалів
У цьому випадку досліджуються радикали R і R '-замісники карбонільної групи; коли вони рівні (ідентичні), кетон називається симетричним; але коли вони різні (як і більшість кетонів), це називається асиметричним.
За насиченням її радикалів
Кетони також можуть бути класифіковані відповідно до насичення їх вуглецевих ланцюгів; Якщо вони знаходяться у формі алканів, то кетон називається насиченим кетоном. Навпаки, якщо ланцюги зустрічаються як алкени або алкіни, то кетон називається ненасиченим кетоном.
Дикетони
Це окремий клас кетону, оскільки ланцюги цього кетону мають у своїй структурі дві карбонільні групи. Деякі з цих кетонів мають унікальні характеристики, такі як більш довга довжина зв'язку між атомами вуглецю.
Наприклад, дикетони, отримані з циклогексану, відомі як хінони, які є лише двома: орто-бензохінон і пара-бензохінон.
Фізико-хімічні властивості кетонів
Кетони, як і більшість альдегідів, є рідкими молекулами і мають ряд фізичних і хімічних властивостей, які змінюються в залежності від довжини їх ланцюгів. Його властивості описані нижче:
Точка кипіння
Кетони є дуже летючими, високополярними і не можуть здавати водні атоми водню для водневих зв'язків (вони не мають атомів водню, приєднаних до карбонільної групи), тому вони мають більш високі точки кипіння, ніж алкени і прості ефіри, але нижче, ніж спиртів однакової молекулярної маси.
Температура кипіння кетону збільшується по мірі збільшення розміру молекули. Це пов'язано з втручанням ван-дер-ваальсових сил і диполь-дипольних сил, які вимагають більшої кількості енергії для розділення атомів і електронів, притягнутих до молекули..
Розчинність
Розчинність кетонів має сильний вплив частково на здатність цих молекул приймати водні атоми кисню і таким чином утворювати водневу зв'язок з водою. Крім того, між кетонами і водою утворюються привабливі, розсіюючі і диполь-дипольні сили, які збільшують їх розчинний ефект.
Кетони втрачають здатність до розчинності більшою їх молекулою, оскільки вони починають вимагати більше енергії для розчинення у воді. Вони також розчинні в органічних сполуках.
Кислотність
Завдяки карбонільної групі кетони мають кислотну природу; це відбувається через резонансну стабілізаційну здатність цієї функціональної групи, яка може передавати протони від своєї подвійної зв'язку, щоб утворити сполучену базу, яка називається енолом.
Реактивність
Кетони є частиною великої кількості органічних реакцій; це відбувається внаслідок сприйнятливості його карбонільного вуглецю до нуклеофільного додавання, крім полярності цього.
Як зазначено вище, висока реакційна здатність кетонів робить їх визнаним проміжним продуктом, який служить основою для синтезу інших сполук.
Номенклатура
Кетони називаються відповідно до пріоритету або важливості карбонільної групи у всій молекулі, тому, коли у вас є молекула, керована карбонільною групою, кетон називається додаванням суфікса "-од" до назви вуглеводню.
Найбільш довгий ланцюг з карбонільної групою береться за основний ланцюг, а потім іменується молекула. Якщо карбонильная група не має пріоритету над іншими функціональними групами молекули, то вона ідентифікується з "-окси".
Для більш складних кетонів положення функціональної групи можна ідентифікувати з числом, а у випадку дикетонів (кетонів з двома ідентичними R і R 'заступниками) молекулу з суфіксом "-dione" називають..
Нарешті, слово "кетон" можна також використовувати після ідентифікації ланцюгів радикалів, приєднаних до карбонільної функціональної групи.
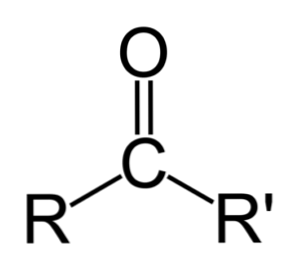
Різниця між альдегідами і кетонами
Найбільшою відмінністю між альдегідами і кетонами є наявність атома водню, приєднаного до карбонільної групи в альдегідах..
Цей атом має важливу дію при залученні молекули в реакцію окислення: альдегід утворює карбонову кислоту або сіль карбонової кислоти в залежності від того, відбувається окислення в кислотних або основних умовах.
Навпаки, кетон не має цього водню, тому мінімальні кроки, необхідні для окислення, не відбуваються.
Існують способи окислення кетону (окислювачі набагато більш потужні, ніж ті, які зазвичай використовуються), але вони розривають молекулу кетону, розділяючи його спочатку на дві або більше частин..
Використовується промислове і повсякденне життя
У промисловості кетони часто спостерігаються в парфумерії і фарбах, беручи ролі стабілізаторів і консервантів, що перешкоджають деградації інших компонентів суміші; вони також мають широкий спектр в якості розчинників у тих галузях, які виробляють вибухові речовини, фарби та текстиль, крім фармацевтичних препаратів.
Ацетон (найменший і найпростіший кетон) - це розчинник, який розпізнається у всьому світі, і його використовують як засіб для видалення фарби і розчинник.
У природі кетони можуть з'являтися як цукру, які називаються кетозами. Кетози є моносахаридами, які містять один кетон на молекулу. Найбільш відомою кетозою є фруктоза, цукор в фруктах і мед.
Біосинтез жирних кислот, що відбувається в цитоплазмі клітин тварин, також відбувається за рахунок дії кетонів. Нарешті, і, як згадувалося вище, можливе підвищення кетонів в крові після голодування або при діабетичних випадках.
Приклади кетонів
Бутанон (C4H8O)
Також відома як МЕК (або МЕК), ця рідина виробляється у великих масштабах в промисловості і використовується як розчинник.
Циклогексанон (C6H10O)
Випускається в масовому масштабі, цей кетон використовується як попередник синтетичного нейлонового матеріалу.
Тестостерон (с19H22O2)
Це головний гормон чоловічої статі і анаболічний стероїд, виявлений у більшості хребетних.
Прогестерон (с21H30O2)
Ендогенний стероїд і статеві гормони беруть участь у менструальному циклі, вагітності та ембріогенезі у людей та інших видів.
Список літератури
- Вікіпедія. (s.f.). Кетон Отримано з en.wikipedia.org
- Britannica, E. (s.f.). Кетон Отримано з britannica.com
- University, M.S. (s.f.). Альдегіди і кетони. Отримано з chemistry.msu.edu
- ChemGuide. (s.f.). Введення альдегідів і кетонів. Отримано з chemguide.co.uk
- Calgary, U. O. (s.f.). Кетони. Отримано з chem.ucalgary.ca


