Атомна модель постулатів Дальтона
The Атомна модель Дальтона або Теорія атома Дальтона, Це була пропозиція, представлена між 1803 і 1807 роками англійським хіміком і математиком Джоном Дальтоном. Це була перша пропозиція концептуальної організації щодо структури та функціонування атомів.
Модель Дальтона відома також як сферична модель, оскільки вона пропонує той факт, що атом є неподільна, тверда і компактна сфера. Завдяки цій моделі було набагато простіше пояснити хімію решті світу, і це стало основою багатьох інноваційних дослідницьких проектів. Можна пояснити, чому речовини реагували в певних станах.
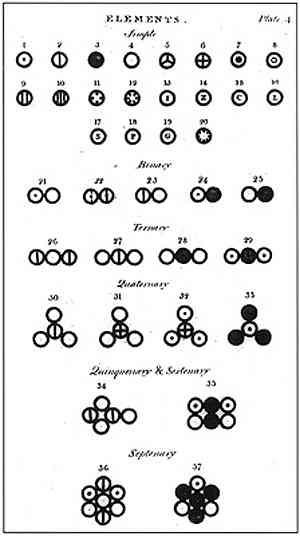
Згідно Дальтону, матерія складалася з мінімальної одиниці, що називається атомом, яка не може бути знищена або розділена будь-яким чином. Цей підрозділ, який раніше був запропонований Демокрітом і його наставником Леукіпо, був основою дослідження Далтона і створення його атомної моделі..
Завдяки цій атомній теорії Джон Далтон намагався взяти на себе ідеї грецьких філософів про існування атома (атомної теорії Всесвіту), але використовуючи в якості платформи різні лабораторні експерименти, які дозволили йому продемонструвати свої ідеї..
Індекс
- 1 Постулати атомної моделі Дальтона
- 1.1 Постулат 1
- 1.2 Постулат 2
- 1.3 Постулат 3
- 1.4 Постулат 4
- 1.5 Постулат 5
- 1.6 Постулат 6
- 2 Помилки атомної моделі Дальтона
- 2.1 Формула води
- 2.2 Склад атомів
- 3 Висновки
- 4 Основні внески Далтона
- 4.1. Попередник атомних теорій
- 4.2 Він заклав основи сучасної хімії
- 4.3 Спочатку публікувати таблицю хімічних ваг
- 4.4 Назвіть колірну сліпоту
- 5 статей
- 6 Посилання
Постулати атомної моделі Дальтона
Далтон сформулював свою атомну модель з 6 постулатами, в яких він пояснює, як він базував свої дослідження і як він їх виконував.
Постулат 1

На зображеному вище зображено резюме моделі Дальтона: атоми будуть крихітними сферами, неподільними, неруйнівними і однорідними..
Перший постулат Дальтона зазначав, що елементи складаються з дрібних частинок, які називаються атомами, які не можна розділити і не можуть бути знищені.
Також Дальтон прокоментував, що ці частинки не можуть змінюватися в будь-якій хімічній реакції.
Постулат 2

Другий постулат Дальтона встановив, що всі атоми, присутні в одному і тому ж елементі, рівні за масою, як і в інших характеристиках.
З іншого боку, встановлено також, що атоми різних елементів мають різну масу. З цієї пропозиції виникло знання відносної атомної ваги, що було продемонстровано при порівнянні різних елементів з воднем.
Постулат 3

Третій постулат Дальтона встановив, що атоми неподільні навіть тоді, коли вони об'єднуються в хімічних реакціях. Вони також не можуть бути створені або знищені.
Комбінація атомів, як рівних, так і різних, буде генерувати більш складні сполуки, але цей процес не змінить того факту, що атом є мінімальною одиницею речовини.
Постулат 4
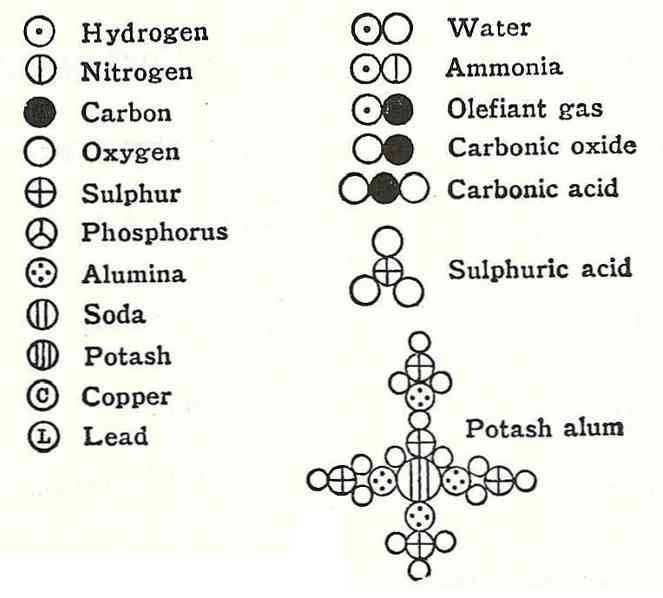
Четвертий постулат Дальтона встановив, що навіть коли атоми об'єднуються, утворюючи з'єднання, вони завжди будуть мати відношення, яке може бути виражене у простих і повних числах. Цей вираз не буде показаний у частках, оскільки атоми є неподільними.
Постулат 5
П'ятий постулат Дальтона зазначав, що існує можлива комбінація різних атомів у різних пропорціях для утворення більш ніж одного з'єднання.
Таким чином, можна пояснити, що з кінцевої кількості атомів прийшла вся існуюча речовина у Всесвіті.
Постулат 6
Шестим і останнім постулатом Далтона було сказано, що кожна хімічна сполука була створена з поєднання атомів двох або більше різних елементів.
Помилки атомної моделі Дальтона
Як і вся теорія в світі науки, було багато спростувань щодо моделі, запропонованої Дальтоном, які були продемонстровані протягом багатьох років, залишаючи за собою інноваційні ідеї Дальтона..
Формула води
Прикладом цього може служити аргумент Дальтона про формулу води, яку, за його словами, складають водень і кисень.
Завдяки цьому твердженню було отримано багато помилок у розрахунку на масу та масу деяких основних сполук, які базувалися на цій інформації.
Через кілька років європейські вчені Gay-Lussac і Alexander von Humbodt спростували цю інформацію і довели, що вода фактично складається з двох воднів і одного кисню. Через 6 років Амадео Авогадро вказував на точний склад води і через це існує Закон Авогадро..
Склад атомів
З іншого боку, у двадцятому столітті був виявлений справжній склад атомів. У цьому випадку було показано, що існує менша одиниця, наприклад, протони, електрони і нейтрони.
Подібним чином, існували різні атомні ваги, встановлені в періодичній таблиці Менделєєва і Мейєра, існування ізотопів і більш специфічних хімічних властивостей, що виникли..
Висновки
Незважаючи на свої помилки, внески Джона Далтона були надзвичайно актуальними у світі науки і викликали переполох у його час через велику кількість інформації, яку він надавав.
Ваші наукові внески залишаються чинними і все ще вивчаються.
Атомна модель Дальтона десятиліттями не ставилась під сумнів своєю значимістю в світі науки і правильним поясненням досліджень і гіпотез, які були представлені в той момент в історії науки..
Основні внески Дальтона
Його внесок у світ науки полягав головним чином у з'ясуванні та формулюванні гіпотез про природу через кількісні тести.
Вчений помер від інфаркту 27 липня 1884 року в Манчестері і незабаром після того, як отримав почесті від монархії.
Попередник атомних теорій
Джон Далтон був англійським хіміком, математиком і хіміком. Він народився 6 вересня 1766 року в Камберленді, Сполучене Королівство і відомий як один з попередників атомних теорій з того моменту, як він представив свою атомну модель..
Він заклав основи сучасної хімії
Далтон відомий як один з попередників у створенні таблиці відносної ваги для хімічних елементів. Цей факт допоміг закласти основи того, що ми знаємо сьогодні як сучасну хімію.
Спочатку публікуємо таблицю хімічних ваг
Далтон був першим вченим, який мав честь опублікувати таблицю атомних ваг, що включали такі елементи, як водень, кисень, фосфор, вуглець і сірку. Завдяки цій публікації Дальтон почав працювати і формувати свою атомну модель.
Дайте назву кольоровій сліпоті
Слід зазначити, що Далтон був одним з перших, хто зареєструвався з проблемами візуалізації, щоб захопити кольори..
Статті, що представляють інтерес
Атомна модель Шредінгера.
Атомна модель Бройля.
Атомна модель Чадвіка.
Атомна модель Гейзенберга.
Атомна модель Перріна.
Атомна модель Томсона.
Атомна модель Дірака Йорданія.
Атомна модель Демокріта.
Атомна модель Бора.
Список літератури
- Теорія атома Дальтона. Отримано 24 листопада 2017 року, з Khanacademy: www.khanacademy.org
- Атомна теорія Дальтона. Отримано 24 листопада 2017 року з Університету Індіани Північно-Заходу: iun.edu
- Атомна теорія. Отримано 24 листопада 2017 року, з Encyclopædia Britannica: www.britannica.com
- Атомна теорія. Отримано 24 листопада 2017 року, з Вікіпедії: en.wikipedia.org
- Історія атомної структури. Отримано 24 листопада 2017 року, з Lumen: courses.lumenlearning.com.


