Характеристики та обмеження атомної моделі Бройля
The Атомна модель Бройля був запропонований французьким фізиком Луїсом Бройлем в 1924 році. У своїй докторській дисертації Броглі затвердив подвійність хвильових частинок електронів, укладаючи основи хвильової механіки. Бройль опублікував важливі теоретичні висновки про хвилеподібну природу речовини в атомному масштабі.
Згодом висловлювання Бройля були експериментально продемонстровані вченими Клінтоном Девіссоном і Лестером Гермером в 1927 році..
Броглі оголосив про те, що речовина має поведінку, подібну до поведінки світла, і запропонувала подібні властивості в субатомних частинках, таких як електрони..
Електричні заряди і орбіти обмежують амплітуду, довжину і частоту хвилі, описаної електронами. Бройль пояснив рух електронів навколо атомного ядра.
Індекс
- 1 Характеристики атомної моделі Бройля
- 2 Експеримент Дейвісона та Гермера
- 3 Обмеження
- 4 статті
- 5 Посилання
Характеристика атомної моделі Бройля
Щоб розробити свою пропозицію, Бройль виходив з принципу, що електрони мають подвійну природу між хвилею і часткою, подібною до світла.
У цьому сенсі Бройль зробив порівняння між обома явищами, і на основі рівнянь, розроблених Ейнштейном для вивчення хвильової природи світла, він вказав наступне: \ t
- Сумарна енергія фотона і, отже, сумарна енергія електрона, випливає з добутку частоти хвилі і константи Планка (6.62606957 (29) × 10). -34 Jules x секунд), як описано в наступному виразі:
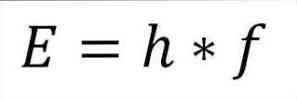
У цьому виразі:
Е = енергія електронів.
h = константа дошки.
f = частота хвилі.
- Лінійний момент фотона, а отже, електрона, обернено пропорційний довжині хвилі, і обидві величини пов'язані через константу Планка:
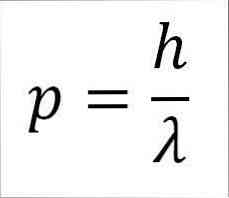
У цьому виразі:
p = лінійний момент електрона.
h = константа дошки.
λ = довжина хвилі.
- Лінійний імпульс - добуток маси частинки за швидкістю, яку має частинка під час її переміщення.
Якщо попереднє математичне вираз реструктурується як функція довжини хвилі, то маємо наступне:
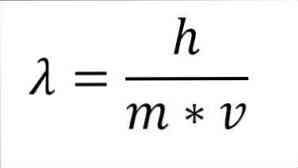
У зазначеному вираженні:
λ = довжина хвилі.
h = константа дошки.
m = маса електрона.
v = швидкість електрона.
Оскільки h, константа Планка, має мале значення, то довжина хвилі λ. Отже, можна стверджувати, що хвильові властивості електрона виникають лише на атомному і субатомном рівнях.
- Бройль також базується на постулатах атомної моделі Бора. Згідно останнього, орбіти електронів обмежені і можуть бути тільки кратними цілими числами. Таким чином:
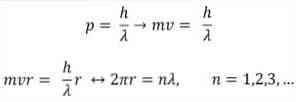
Де:
λ = довжина хвилі.
h = константа дошки.
m = маса електрона.
v = швидкість електрона.
r = радіус орбіти.
n = ціле число.
Відповідно до атомної моделі Бора, яку Бройль прийняв за основу, якщо електрони поводяться як стоячі хвилі, то єдиними дозволеними орбітами є ті, радіус яких дорівнює цілому кратному довжині хвилі λ..
Тому не всі орбіти відповідають параметрам, необхідним для переміщення електрона через них. Ось чому електрони можуть подорожувати тільки в конкретних орбітах.
Хвильова теорія електронів Бройля виправдала успіх атомної моделі Бора для пояснення поведінки одного електрона атома водню..
Аналогічно він також проливає світло на те, чому ця модель не вписувалася в більш складні системи, тобто атоми з більш ніж одним електроном.
Девісон і Гермер експериментують
Експериментальна перевірка атомної моделі Бройля відбулася через 3 роки після її публікації, в 1927 році.
Видатні американські фізики Клінтон Дж. Девісон і Лестер Гермер експериментально підтвердили теорію хвильової механіки.
Девісон і Гермер проводили тести розсіювання електронного пучка через кристал нікелю і спостерігали дифракційне явище через металеву середу.
Проведений експеримент полягав у проведенні наступної процедури:
- В першу чергу, був розміщений вузол з електронним пучком, який мав відому початкову енергію.
- Джерело напруги було встановлено для прискорення руху електронів, що викликало різницю потенціалів.
- Потік електронного пучка був спрямований у бік металевого кристала; у цьому випадку нікель.
- Вимірювали кількість електронів, що впливали на кристал нікелю.
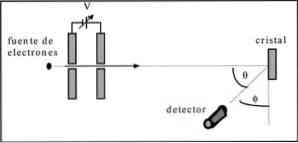
Наприкінці експерименту Девіссон і Гермер виявили, що електрони розсіяні в різних напрямках.
Повторюючи експеримент з використанням металевих кристалів з різними орієнтаціями, вчені виявили наступне:
- Дисперсія електронного пучка через металевий кристал була порівнянна з явищем інтерференції і дифракції світлових променів.
- Відбиття електронів на кристалі впливу описувало траєкторію, яка, теоретично, повинна описувати згідно теорії електронних хвиль Бройля..
У синтезі експеримент Девісона і Гермера експериментально довів подвійну хвильову частку природи електронів.
Обмеження
Атомна модель Бройля не передбачає точного розташування електрона на орбіті, в якій він рухається.
У цій моделі електрони сприймаються як хвилі, що переміщаються навколо орбіти без конкретного місця, що вводить поняття електронної орбіталі.
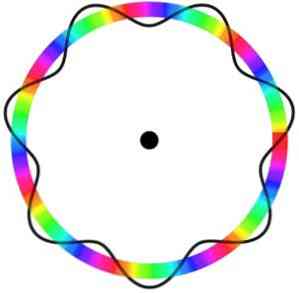
Крім того, атомна модель Бройля, аналогічна моделі Шредінгера, не розглядає обертання електронів на її осі (спина).
Ігноруючи власний кутовий момент електронів, просторові варіації цих субатомних частинок не враховуються..
У тому ж порядку ідей ця модель не враховує змін у поведінці швидких електронів як наслідок релятивістських ефектів.
Статті, що представляють інтерес
Атомна модель Шредінгера.
Атомна модель Чадвіка.
Атомна модель Гейзенберга.
Атомна модель Перріна.
Атомна модель Томсона.
Атомна модель Дальтона.
Атомна модель Дірака Йорданія.
Атомна модель Демокріта.
Атомна модель Бора.
Список літератури
- Квантова теорія Бора і Хвилі Де Бройля (с.ф.). Отримано з: ne.phys.kyushu-u.ac.j
- Луї де Бройль - біографічний (1929). © Нобелівський фонд. Отримано з: nobelprize.org
- Луї-Віктор де Бройль (с.ф.). Отримано з: chemed.chem.purdue.edu
- Lovett, B. (1998). Луї де Бройль. Encyclopædia Britannica, Inc. Отримано з: britannica.com
- Атомна модель Де Бройля. Національний університет дистанційної освіти. Іспанія Отримано з: ocw.innova.uned.es
- Хвилі матерії Луї де Бройля (с.ф.). Отримано з: hiru.eus
- Von Pamel, O., і Marchisio, S. (s.f.). Квантова механіка Національний університет Росаріо. Отримано з: fceia.unr.edu.ar


