Балансування методів і прикладів хімічних рівнянь
The балансування хімічних рівнянь мається на увазі, що всі елементи, присутні в згаданому рівнянні, мають однакову кількість атомів на кожній стороні. Для досягнення цього необхідно використовувати методи балансування для призначення стехіометричних коефіцієнтів, придатних для кожного виду, присутнього в реакції..
Хімічне рівняння - це представлення, за допомогою символів, про те, що відбувається в ході хімічної реакції між двома або більше речовинами. Реагенти взаємодіють один з одним і в залежності від умов реакції в якості продукту буде отримано одне або кілька різних сполук..
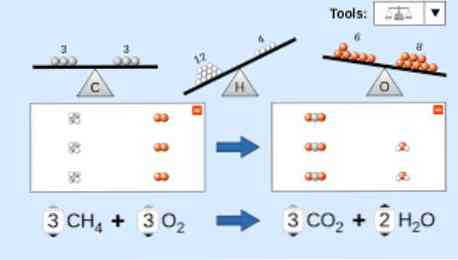
При описі хімічного рівняння необхідно взяти до уваги наступне: По-перше, речовини реагентів записуються на лівій стороні рівняння, за якими слідує однонаправлена стрілка або дві протилежні горизонтальні стрілки, залежно від типу реакції, що проводиться. мис.
Індекс
- 1 Методи балансування хімічних рівнянь
- 1.1 Баланс хімічних рівнянь методом проб і помилок (також називається перевіркою або випробуванням)
- 1.2 Алгебраїчне балансування хімічних рівнянь
- 1.3 Прокатка окислювально-відновних рівнянь (іон-електронний метод)
- 2 Приклади балансування хімічних рівнянь
- 2.1 Перший приклад
- 2.2 Другий приклад
- 2.3 Третій приклад
- 3 Посилання
Методи балансування хімічних рівнянь
Взявши за основу, що реагенти і продукти відомі, а їх формули правильно виражені на тій стороні, яка їм відповідає, переходимо до балансування рівнянь за такими методами:.
Балансування хімічних рівнянь методом проб і помилок (також називається перевіркою або випробуванням)
Вона базується на стехіометрії реакції і намагається спробувати різні коефіцієнти для того, щоб врівноважити рівняння, доки будуть обрані найменші можливі цілі числа, з яких з обох сторін буде отримано однакове число атомів кожного елемента. реакції.
Коефіцієнт реагенту або продукту - це число, яке передує його формулі, і це єдине число, яке може бути змінено при балансуванні рівняння, оскільки зміна індексів формул змінить ідентичність сполуки. під питанням.
Перерахуйте і порівняйте
Після ідентифікації кожного елемента реакції і розміщення його на правильній стороні, ми переходимо до підрахунку і порівняння числа атомів кожного елемента, присутнього в рівнянні, і визначаємо ті, які повинні бути збалансованими..
Потім ми продовжуємо балансування кожного елемента (по одному за раз), розміщуючи цілі коефіцієнти перед кожною формулою, що містить незбалансовані елементи. Зазвичай металеві елементи спочатку врівноважуються, потім неметалеві елементи і, нарешті, атоми кисню і водню.
Таким чином кожен коефіцієнт примножує всі атоми попередньої формули; тому, балансуючи елемент, інші можуть розбалансувати, але це виправлено, оскільки реакція збалансована.
Нарешті, це підтверджується останнім підрахунком, що все рівняння правильно збалансоване, тобто що він підкоряється закону збереження матерії.
Алгебраїчне балансування хімічних рівнянь
Для використання даного методу встановлюється процедура для трактування коефіцієнтів хімічних рівнянь як невідомих системи, які необхідно вирішити..
По-перше, конкретний елемент реакції приймається за еталон, а коефіцієнти розміщуються як літери (a, b, c, d ...), які представляють невідомі, відповідно до існуючих атомів цього елемента в кожній молекулі (якщо вид не містить цього елемента, який поміщений "0").
Після отримання цього першого рівняння визначають рівняння для інших елементів, присутніх в реакції; буде стільки ж рівнянь, скільки є елементів у згаданій реакції.
Нарешті, невідомі визначаються одним з алгебраїчних методів відновлення, вирівнювання або заміщення, і отримані коефіцієнти, які приводять до правильно збалансованого рівняння.
Балансування окисно-відновних рівнянь (іон-електронний метод)
Спочатку загальна (незбалансована) реакція поміщена в її іонну форму. Тоді це рівняння ділиться на дві напівреакції, окислення і відновлення, кожна з яких балансується за кількістю атомів, їх тип і заряди цих.
Наприклад, для реакцій, що відбуваються в кислотному середовищі, додаються молекули Н.2Або збалансувати атоми кисню і додати H+ щоб збалансувати атоми водню.
Навпаки, в лужному середовищі додають рівну кількість іонів OH- на двох сторонах рівняння для кожного H іона+, і де іони H виникають+ і OH- вони об'єднуються, утворюючи молекули Н2O.
Додайте електрони
Потім необхідно додати стільки електронів, скільки необхідно, щоб збалансувати заряди, після балансування речовини в кожній половині реакції.
Після прокатки кожної половини реакції їх додають і завершують балансуванням остаточного рівняння методом проб і помилок. У випадку, якщо існує різниця в кількості електронів двох напівреакцій, один або обидва повинні бути помножені на коефіцієнт, що дорівнює цьому числу.
Нарешті, необхідно підтвердити, що рівняння включає одне і те ж число атомів і одного і того ж типу атомів, крім того, що мають однакові заряди з обох сторін глобального рівняння.
Приклади балансування хімічних рівнянь
Перший приклад
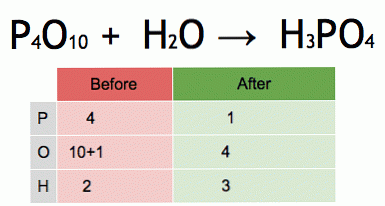
Це анімація збалансованого хімічного рівняння. Пентаоксид фосфору і вода перетворюються на фосфорну кислоту.
P4O10 + 6 H2O → 4 H3PO4 (-177 кДж).
Другий приклад
Ви маєте реакцію горіння етану (незбалансована).
C2H6 + O2 → CO2 + H2O
Використовуючи метод проб і помилок для його балансування, спостерігається, що жоден з елементів не має однакового числа атомів по обидві сторони рівняння. Таким чином, він починається з балансу вуглецю, додаючи два як стехіометричний коефіцієнт, який супроводжує його на стороні виробів.
C2H6 + O2 → 2CO2 + H2O
Вуглець був збалансований з обох сторін, тому ми приступаємо до балансування водню, додаючи три молекули води.
C2H6 + O2 → 2CO2 + 3H2O
Нарешті, оскільки на правій стороні рівняння є сім атомів кисню, а останній елемент ще має бути збалансованим, фракційне число 7/2 розміщується перед молекулою кисню (хоча цілі коефіцієнти взагалі кращі).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Потім перевіряємо, що на кожній стороні рівняння є однакове число атомів вуглецю (2), водень (6) і кисень (7)..
Третій приклад
Окислення заліза дихроматними іонами відбувається в кислому середовищі (незбалансований і в іонній формі).
Віра2+ + Cr2O72- → Віра3+ + Cr3+
Використовуючи іонно-електронний метод для її балансування, він ділиться на дві напів-реакції.
Окислення: Віра2+ → Віра3+
Скорочення: Cr2O72- → Cr3+
Оскільки атоми заліза вже врівноважені (1: 1), на сторону продуктів додається електрон, щоб збалансувати заряд.
Віра2+ → Віра3+ + e-
Тепер атоми Cr врівноважені, додаючи два в праву частину рівняння. Потім, коли реакція відбувається в кислотному середовищі, додають сім молекул Н.2Або на стороні продуктів, щоб врівноважити атоми кисню.
Cr2O72- → 2Cr3+ + 7H2O
Для балансування атомів Н додано чотирнадцять іонів Н+ на стороні реагентів і, після вирівнювання матеріалу, заряди збалансовані додаванням шести електронів на одній стороні.
Cr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Нарешті, обидві напівреакції додаються, але оскільки в реакції окислення є тільки один електрон, все це необхідно помножити на шість..
6Fe2+ + Cr2O72- +14H+ + 6e- → Віра3+ + 2Cr3+ + 7H2O + 6e-
Нарешті, електрони повинні бути усунені з обох сторін глобального іонного рівняння, перевіряючи, що їх заряд і речовина правильно збалансовані.
Список літератури
- Chang, R. (2007). Хімія (9-е изд.). McGraw-Hill.
- Hein, M., and Arena, S. (2010). Основи хімії коледжу, альтернативні. Отримано з books.google.co.ve
- Tuli, G. D., і Soni, P. L. (2016). Мова хімії або хімічних рівнянь. Отримано з books.google.co.ve
- Швидке видання (2015). Хімічні рівняння та відповіді (Speedy Study Guides). Отримано з books.google.co.ve


