Характеристики біхромату натрію, виробництво, небезпеки та застосування
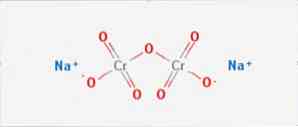
The дихромат натрію являє собою неорганічне з'єднання формули Na2Cr2O7. Це одне з багатьох шестивалентних сполук хрому (Cr VI). Його структура проілюстрована на фіг.1, хоча зазвичай сіль обробляється в дигідратній формі, формулою якої є Na2Cr2O7 · H2O.
Він має дві іонні зв'язки між молекулами натрію і негативно зарядженими кисень. Хромову руду екстрагують з біхромату натрію. Щорічно виробляються мільйони кілограмів біхромату натрію.
Китай є найбільшим виробником біхромату натрію, однак китайські хімічні заводи мають відносно низьке виробництво, менше 50 000 тонн на рік, у порівнянні з казахстанським заводом, який виробляє більше 100 000 тонн на рік.
Рослини в Росії, Сполучених Штатах і Сполученому Королівстві мають проміжне виробництво від 50 000 до 100 000 тонн на рік (Kogel, 2006).
З точки зору реактивності та зовнішнього вигляду, біхромат натрію має властивості, подібні до біхромату калію, однак натрієва сіль є більш розчинною у воді і має вагову еквівалентну масу, ніж калієва сіль..
Дихромат натрію виробляє токсичні пари хрому при нагріванні. Він є сильним окислювачем і має високу корозію.
Ця сполука може бути знайдена у джерелах питної води, забруднених різними промисловими процесами, такими як техніка гальванізації або гальванізації, шкіряна обробка і виробництво текстилю.
Індекс
- 1 Фізико-хімічні властивості
- 2 Методи виробництва
- 3 Реактивність і небезпека
- 4 Використання та застосування
- 5 Біохімія
- 6 Посилання
Фізико-хімічні властивості
Дихромат натрію складається з кристалів з червоно-оранжевою моноклінною структурою в безводній і без запаху формі. Його молекулярна маса становить 261,97 г / моль у своїй безводній формі і 298,00 г / моль у її дигідратній формі.
Він має температуру плавлення 356,7 градусів Цельсія, точку кипіння 400 градусів за Цельсієм, в якій він розкладається. Він має щільність 2,52 г / мл.

На фіг.2 показаний зовнішній вигляд дихромата натрію. Розчинність у воді становить 187 г на 100 грамів при температурі 25 градусів Цельсія, а розчинність у етанолі - 513,2 г на літр при 19,4 градуса Цельсія (Національний центр біотехнологічної інформації, ср.).
Вважається стабільною сполукою при зберіганні в рекомендованих умовах і не є вогненебезпечним. Оскільки він є сильним окислювачем, він є корозійним, а в розчині він є кислотою, здатною знижувати рН до 4 в розчині 1% мас. / Об..
Методи виробництва
Хромат натрію може бути перетворений в дихромат безперервним процесом, який обробляється сірчаною кислотою, діоксидом вуглецю або комбінацією цих двох.
Випарювання дихроматного розчину натрію призводить до осадження сульфату натрію та / або бікарбонату натрію, і ці сполуки видаляються до кінцевої кристалізації біхромату натрію..
Дихромат натрію може бути виконаний у тристадійному процесі:
- Лужне обжарювання умов окислення хроміту
- Вилуговування. Екстракція розчинної речовини з суміші під дією рідкого розчинника
- Конверсія монохромату натрію в дихромат натрію за допомогою кислоти.
Безводний дихромат натрію може бути отриманий плавленням дигідрату дигідрату натрію, кристалізуючих водних розчинів дихромата вище 86 градусів С або сушіння розчинів біхромату натрію в розпилювальних сушарках.
Розчини біхромату натрію 69 і 70% мас. / Об. Використовуються як зручний і економічно ефективний спосіб відправки кількостей, уникаючи необхідності ручного поводження або розчинення кристалів.
Реактивність і небезпека
Це сильний окислювач. Несумісна з сильними кислотами. Контакт з горючими матеріалами може викликати пожежі. Токсичні пари оксиду хрому можуть утворюватися в присутності тепла або вогню.
Відома "суміш хромової кислоти" з дихромата і сірчаної кислоти з органічними залишками призводить до сильної екзотермічної реакції. Ця суміш у поєднанні з залишками ацетону також призводить до сильної реакції.
Поєднання дихромата і сірчаної кислоти зі спиртами, етанолом і 2-пропанолом призводить до сильної екзотермічної реакції. Через виникнення багатьох випадків, пов'язаних із змішуванням дихромат-сірчаної кислоти з окислюються органічними матеріалами, можливо, краще уникати таких взаємодій.
Комбінація біхромату з гідразином є вибухонебезпечною, причому реакцію дихромата можна очікувати, що вона є енергійною з амінами в цілому. Додавання зневодненої солі біхромату до оцтового ангідриду призводить до остаточно вибухової екзотермічної реакції.
Бор, кремній і дихромати утворюють піротехнічні суміші. Суміш оцтової кислоти, 2-метил-2-пентеналу і дихромата призводить до бурхливої реакції (Dichromate. Sodium Dichromate., 2016).
Вдихання пилу або туману викликає подразнення дихальних шляхів, що іноді нагадує астму. Можлива перфорація перегородки. Вважається отрутою.
Прийом всередину викликає блювоту, діарею, і, дуже незвично, ускладнення шлунка і нирок. Контакт з очима або шкірою викликає місцеве подразнення. Повторне вплив на шкіру викликає дерматит.
Дихромат натрію є канцерогеном у людини. Є дані, що шестивалентні сполуки хрому або Cr (VI) можуть викликати рак легенів у людей. Було показано, що біхромат натрію викликає рак легенів у тварин.
Хоча дихромат натрію не був ідентифікований як тератогенна сполука або репродуктивний ризик, відомо, що з'єднання шестивалентного хрому або Cr (VI) є тератогенними і викликають пошкодження репродуктивної системи, такі як зниження фертильності та перешкоджання менструальних циклів.
Дихромат натрію може спричинити ураження печінки і нирок, тому його необхідно керувати надзвичайно обережно (Міністерство охорони здоров'я Нью-Джерсі, 2009).
У разі проковтування, потерпілий повинен пити воду або молоко; ніколи не викликайте блювоту. У разі контакту зі шкірою або очима слід обробляти кислотні опіки; Промийте очі водою протягом принаймні 15 хвилин.
Зовнішні вогнища можна розтирати 2% розчином тіосульфату натрію. У всіх випадках необхідно звернутися до лікаря.
Використання та застосування
Крім його важливості у виробництві інших хімічних речовин хрому, біхромат натрію також має багато прямих застосувань як інгредієнт у виробництві:
- Металеве покриття: сприяє корозійній стійкості та очищенню металевих поверхонь, а також сприяє адгезії фарби.
- Органічні продукти: використовуються як окислювачі у виробництві таких продуктів, як вітамін К і віск.
- Пігменти: використовуються у виробництві неорганічних хроматних пігментів, де він виробляє цілий ряд кольорів, стійких до світла. Деякі сорти хромата також використовуються в якості інгібіторів корозії в нижніх шарах і праймерах.
- Кераміка: використовується при приготуванні кольорових стекол і керамічних глазурі.
- Текстильна: використовується як протрава для кислотних барвників для поліпшення її швидкофарбувальних властивостей.
- Виробництво сульфату хрому.
(Дихромат натрію, будівельний блок практично для всіх інших сполук хрому., 2010-2012)
Дихлорат натрію дихідрат, його використання ідеально підходить в різних умовах, включаючи високотемпературні додатки, такі як керамічні глазурі і кольорове скло.
Хромовий оксид, який є твердішим за інші оксиди металів, наприклад титан або залізо, ідеально підходить для середовищ, де температура та умови процесу є агресивними.
Ця речовина в основному використовується для виробництва інших сполук хрому, але також використовується в бентонітових грязьях, що використовуються у виробництві нафти, в консервантах деревини, у виробництві органічних хімікатів і в якості інгібіторів корозії..
При змішуванні з дихроматом алюмінію і калію, використовуючи алюмотермічний процес, оксид хрому виробляє металевий хром високої чистоти. Це важливий компонент у виробництві високопродуктивних суперсплавів, що використовуються в аерокосмічній промисловості.
У органічному синтезі в якості окислювача в реакціях відновлення оксиду використовують біхромат натрію в присутності сірчаної кислоти.
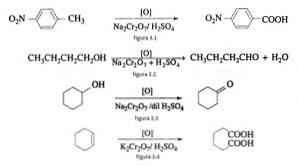
Наприклад окислення п-нитротолуола з утворенням п-нітробензойної кислоти, при окисленні н-бутанолу з утворенням н-бутальдегіду, при утворенні циклогексанону з циклогексанолу і утворення адипінової кислоти, як показано на фігурах 3.1 , 3.2, 3.3 та 3.4 відповідно (VK Ahluwalia, 2004).
Біохімія
Інтратрахеальне інстиляція біхромату натрію (CrVI) і гідроксиду ацетату хрому (CrIII) у щурів-самців призвела до підвищення концентрації хрому в цільній крові, плазмі та сечі до 72 годин після впливу; Максимальні концентрації були досягнуті через 6 годин після впливу.
Співвідношення між вмістом хрому в цільній крові та концентрацією хрому в плазмі було суттєво різним для лікування Cr (VI) і Cr (III). Тому для оцінки експозиції хрому слід використовувати аналізи хрому в крові та хрому в плазмі.
Хром також був виявлений в периферичних лімфоцитах. Cr (VI), але не Cr (III) накопичилися значним чином у лімфоцитах після лікування. Ці клітини мають потенціал для використання в якості біомаркерів при оцінці впливу сполук хрому (Hooth, 2008).
Список літератури
- Хімічна таблиця натрію дихромат. (2016). Отримано з камеї хімії: cameochemicals.noaa.
- Hooth, M.J. (2008). Технічний звіт про вивчення токсикології та канцерогенезу дихлорату натрію. Національний інститут здоров'я США.
- Когель, Дж. Е. (2006). Промислові мінерали та породи: товари, ринки та використовує сьоме видання. littleton Колорадо: суспільство гірничодобувної, металургійної та розвідки вкл.
- Національний центр біотехнологічної інформації. (s.f.). База даних PubChem Compound; CID = 25408. Отримано з pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Міністерство охорони здоров'я Нью-Джерсі. (2009, листопад). hazartdous речовина фактура дихромат натрію. Отримано від nj.gov: nj.gov.
- Дихромат натрію. Будівельний блок практично для всіх інших сполук хрому. (2010-2012). Отримано з elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Комплексна практична органічна хімія: препарати та кількісні аналізи. Делі: Університетська преса (Індія).


