Типи молекулярної геометрії та приклади
The молекулярної геометрії o молекулярної структури є просторовим розподілом атомів навколо центрального атома. Атоми представляють області, де є висока електронна щільність, і тому вважаються електронними групами, незалежно від ланок, що утворюють (одиночні, подвійні або потрійні)..
Ця концепція походить з комбінації та експериментальних даних двох теорій: валентної зв'язку (TEV) і відштовхування електронних пар валентної оболонки (VSPR). Поки перша визначає ланки і їх кути, друга встановлює геометрію і, отже, молекулярну структуру.

Які геометричні форми є молекулами, здатними прийняти? Дві попередні теорії дають відповіді. Відповідно до VSEPR, атоми і пари вільних електронів повинні бути розташовані в просторі таким чином, щоб мінімізувати електростатичне відштовхування між ними..
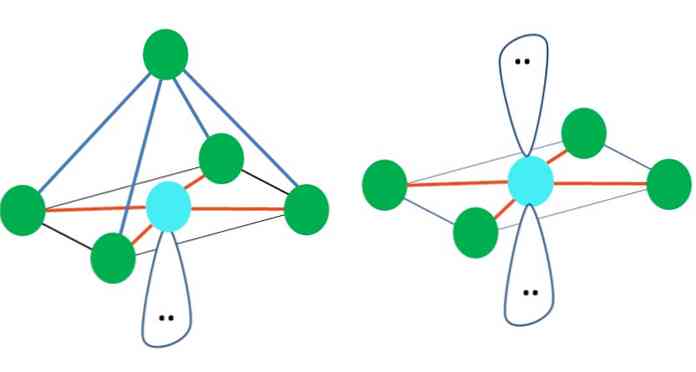
Таким чином, геометричні фігури не є довільними, але шукають найбільш стійкий дизайн. Наприклад, у верхньому зображенні зліва видно трикутник, а праворуч - восьмигранник. Зелені точки являють собою атоми, а оранжеві смуги - ланки.
У трикутнику три зелені точки орієнтовані у відриві 120º. Цей кут, який дорівнює тому куту зв'язку, дозволяє атомам якнайменше відштовхуватися один від одного. Тому молекула з центральним атомом, приєднаним до трьох інших, прийме тригональну геометричну площину.
Однак VSCR передбачає, що вільна пара електронів в центральному атомі спотворює геометрію. Для випадку тригональної площини ця пара буде проштовхувати три зелені точки, що призведе до тригональної геометрії піраміди.
Те ж саме може статися і з октаедром зображення. У ньому всі атоми розділені найбільш стійким можливим способом.
Індекс
- 1 Як заздалегідь знати молекулярну геометрію атома X?
- 2 типи
- 2.1 Лінійний
- 2.2 Кутове
- 2.3
- 2.4 Тригональна біпіраміда
- 2,5 восьмигранний
- 2.6 Інші молекулярні геометрії
- 3 Приклади
- 3.1 Лінійна геометрія
- 3.2 Кутова геометрія
- 3.3 Тригональний план
- 3.4
- 3.5 Тригональна піраміда
- 3.6 тригональна біпіраміда
- 3.7 Коливання
- 3.8 Форма Т
- 3.9
- 4 Посилання
Як заздалегідь знати геометрію молекули атома X?
Для цього необхідно також розглядати пари вільних електронів як електронні групи. Вони, разом з атомами, визначать те, що відомо як електронна геометрія, що є нерозривним супутником молекулярної геометрії.
З електронної геометрії і, виявивши структурою Льюїса пари вільних електронів, можна встановити, якою буде молекулярна геометрія. Сума всіх молекулярних геометрій забезпечить контур глобальної структури.
Типи
Як видно з основного зображення, молекулярна геометрія залежить від того, скільки атомів оточує центральний атом. Однак, якщо пара електронів присутня без спільного використання, вона змінить геометрію, оскільки вона займає багато об'єму. Тому він проявляє стеричний ефект.
Згідно з цим, геометрія може представляти ряд характерних форм для багатьох молекул. І тут виникають різні типи молекулярної геометрії або молекулярної структури.
Коли геометрія дорівнює структурі? Обидва вони позначають одне й те саме тільки в тих випадках, коли структура не має більше одного типу геометрії; інакше, всі існуючі типи повинні бути розглянуті, а структура - глобальна (лінійна, розгалужена, глобулярна, плоска тощо).
Геометрия особливо корисна для пояснення структури твердого тіла з його структурних одиниць.
Лінійний
Всі ковалентні зв'язки є спрямованими, тому зв'язок A-B є лінійною. Але чи буде молекула АБ лінійною?2? Якщо так, то геометрія просто представлена як: B-A-B. Два атоми B розділені на кут 180 °, а згідно TEV A має гібридні орбіталі.
Кутовий
У першому випадку можна припустити лінійну геометрію для молекули АВ2; однак, необхідно зробити структуру Льюїса перед тим, як дійти висновку. Малюючи структуру Льюїса, можна ідентифікувати кількість пар електронів, не поділяючи (:) на атом А.
Коли це відбувається так, на вершині електронних пар вони виштовхують два атоми B вниз, змінюючи свої кути. В результаті лінійна молекула B-A-B закінчується станом V, бумерангом або кутовою геометрією (top image)
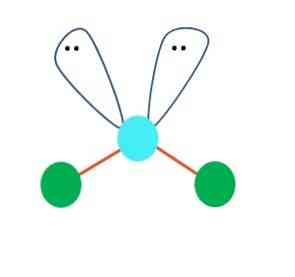
Молекула води, H-O-H, є ідеальним прикладом для такого типу геометрії. У атомі кисню є дві пари електронів без спільного використання, які орієнтовані під наближеним кутом 109º.
Чому цей кут? Тому що електронна геометрія є чотиригранною, яка має чотири вершини: два для атомів Н, а два для електронів. На зображенні вище зазначте, що зелені точки і дві "лопатки з очима" малюють тетраедр з блакитною точкою в її центрі.
Якщо б О не мав вільних електронних пар, вода утворювала б лінійну молекулу, її полярність зменшувалася, а океани, моря, озера тощо, ймовірно, не існували б, як вони відомі..
Тетраедральний
Верхнє зображення являє собою тетраедричну геометрію. Для молекули води її електронна геометрія чотиригранна, але, усуваючи вільні від електронів пари, можна помітити, що вона перетворюється в кутову геометрію. Це також спостерігається просто шляхом усунення двох зелених точок; решта два будуть малювати V з синьою крапкою.
Що робити, якщо замість двох пар вільних електронів залишилося тільки одне? Тоді буде тригональна площина (головне зображення). Однак, усуваючи електронну групу, стеричний ефект, що утворюється парою вільних електронів, не уникнути. Тому вона спотворює тригональну площину до трикутної базової піраміди:

Хоча геометрія молекули тригональної і тетраедричної піраміди відрізняється, електронна геометрія однакова: чотиригранна. Отже, тригональна піраміда не враховується як електронна геометрія?
Відповідь "ні", оскільки вона є продуктом спотворення, викликаного "пелюсткою з очима", і його стеричним ефектом, і ця геометрія не враховує пізніші спотворення.
З цієї причини завжди важливо спочатку визначити електронну геометрію за допомогою структур Льюїса перед визначенням геометрії молекули. Молекула аміаку NH3, є прикладом тригональної піраміди молекулярної геометрії, але з тетраедричною електронною геометрією.
Тригональна біпіраміда
До теперішнього часу, за винятком лінійної геометрії, в чотиригранній, кутовій і тригональній пірамідах її центральні атоми мають sp-гібридизацію3, згідно ТЕВ. Це означає, що якщо кути вашого зв'язку визначаються експериментально, вони повинні бути близько 109º.
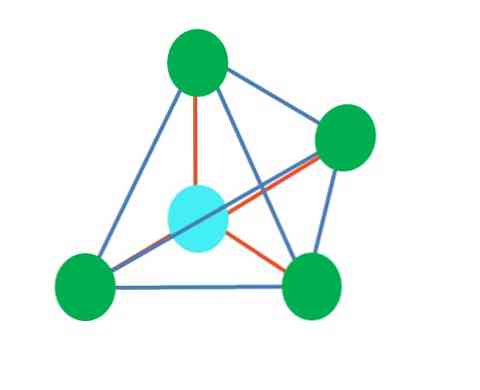
З тригональної дипірамідальної геометрії навколо центрального атома є п'ять електронних груп. У верхньому зображенні можна побачити п'ять зелених точок; три в трикутній основі і два в осьових положеннях, які є верхніми і нижніми вершинами піраміди.
Яка гібридизація має синя точка? Для формування простих зв'язків (помаранчевих) потрібні п'ять гібридних орбіталей. Це досягається за допомогою п'яти СП орбіталей3d (добуток суміші орбітального s, трьох p і a d).
Розглядаючи п'ять електронних груп, геометрія є вже викритою, але, маючи пари електронів без спільного використання, ця знову страждає від спотворень, які генерують інші геометрії. Також виникає наступне питання: чи можуть ці пари зайняти будь-яку позицію в піраміді? Це: осьова або екваторіальна.
Осьові та екваторіальні положення
Зелені точки, що складають трикутну основу, знаходяться в екваторіальних положеннях, а два на верхньому і нижньому кінцях, в осьових положеннях. Де, бажано, буде розташована пара електронів без спільного використання? У такому положенні мінімізує електростатичне відштовхування і стеричний ефект.
У осьовому положенні пара електронів "натискають" перпендикулярно (90º) на трикутній основі, а якщо вона знаходиться в екваторіальному положенні, то дві залишені електронні групи основи будуть розділені на 120º і натискають обидва кінці на 90º (замість три, як з базою.
Тому центральний атом буде прагнути орієнтувати свої вільні від електронів пари в екваторіальних положеннях для створення більш стійкої молекулярної геометрії.
Коливальна і форма Т
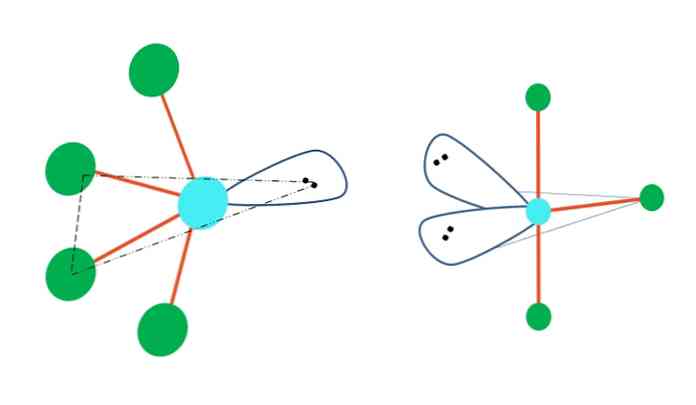
Якби геометрія тригональної біпіраміди замінила один або кілька її атомів на вільні від електронів пари, вона також мала б різні молекулярні геометрії.
Ліворуч від верхнього зображення геометрія змінюється на коливальну форму. У ній вільна пара електронів штовхає решту чотирьох атомів в одному напрямку, складаючи свої ланки вліво. Зауважимо, що ця пара і два атоми лежать в одній трикутній площині вихідної дипіраміди.
А праворуч від зображення - Т-подібна геометрія - ця молекулярна геометрія є результатом заміни двох атомів на дві пари електронів, внаслідок чого залишилися три атома вирівняні в одній площині, що малює рівно одну літеру. T.
Отже, для молекули типу АВ5, він приймає тригональну географію біпіраміди. Однак AB4, з тією ж електронною геометрією, він буде застосовувати коливальну геометрію; і AB3, Т-подібна геометрія У всіх них А буде мати (в основному) sp гібридизацію3d.
Для визначення молекулярної геометрії необхідно намалювати структуру Льюїса і, відповідно, її електронну геометрію. Якщо це тригональна біпираміда, то безвільні пари будуть відкинуті, але не їх стеричні ефекти на інші атоми. Таким чином, можна чудово розрізняти три можливі молекулярні геометрії.
Восьмигранний
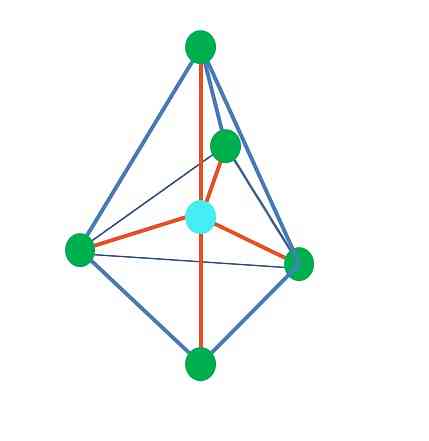
Праворуч від головного зображення представлена восьмигранна молекулярна геометрія. Цей тип геометрії відповідає сполукам АВ6. AB4 вони утворюють квадратну основу, а решта два B розташовані в осьових положеннях. Таким чином, утворюються кілька рівносторонніх трикутників, які є гранями октаедра.
Тут, знову ж таки, можуть бути (як у всіх електронних геометріях) вільні електронні пари, і тому з цього факту випливають інші молекулярні геометрії. Наприклад, AB5 з восьмигранною електронною геометрією складається з піраміди з квадратним підставою і АВ4 квадратної площини:
Для випадку восьмигранної електронної геометрії ці дві молекулярні геометрії є найбільш стійкими з точки зору електростатичного відштовхування. У квадратно-плоскої геометрії дві електронні пари знаходяться на 180 °.
Що таке гібридизація для атома А в цих геометріях (або структурах, якщо вона єдина)? Знову ж таки, TEV встановлює, що він є sp3d2, шість гібридних орбіталей, що дозволяє А орієнтувати електронні групи на вершини октаедра.
Інші молекулярні геометрії
Змінюючи основи згаданих пірамід, можна отримати більш складні молекулярні геометрії. Наприклад, п'ятикутна біпіраміда заснована на п'ятикутника і сполуки, які утворюють його, мають загальну формулу А7.
Як і інші молекулярні геометрії, підстановка атомів B для вільних від електронів пар буде спотворювати геометрію до інших форм.
Також, сполуки АВ8 вони можуть приймати такі геометрії, як квадратний антипризм. Деякі геометрії можуть бути дуже складними, особливо для формул AB7 далі (до AB12).
Приклади
Далі буде згадано ряд сполук для кожної основної молекулярної геометрії. Як вправу, ви можете намалювати структури Льюїса для всіх прикладів і сертифікувати, якщо, з огляду на електронну геометрію, ви отримаєте молекулярну геометрію, як зазначено нижче..
Лінійна геометрія
-Етилен, Н2C≡CH2
-Хлорид берилію, BeCl2 (Cl-Be-Cl)
-Вуглекислий газ, CO2 (O = C = O)
-Азот, N2 (N≡N)
-Дибромид ртуті, HgBr2 (Br-Hg-Br)
-Аніон трийодид, I3- (I-I-I)
-Ціанід водню, HCN (H-N≡C)
Його кути повинні бути 180º, і тому мають sp-гібридизацію.
Кутова геометрія
-Вода
-Діоксид сірки, SO2
-Діоксид азоту, NO2
-Озон, O3
-Аніон амідуро, NH2-
Тригональний літак
-Трифторид брому, BF3
-Трихлорид алюмінію, AlCl3
-Аніон нітрату, NO3-
-Аніон-карбонат CO32-
Тетраедральний
-Газ метану, СН4
-Тетрахлорид вуглецю, CCl4
-Катіон амонію, NH4+
-Аніон сульфат, SO42-
Тригональна піраміда
-Аміак, NH3
-Катіонний гідроніум, Н3O+
Тригональна біпіраміда
-Пентафторид фосфору, ПФ5
-Пентахлорид сурми, SbF5
Коливальний
Тетрафторид сірки, SF4
Форма Т
-Трихлорид йоду, ICl3
-Хлорид трифторид, ClF3 (обидва сполуки відомі як інтергалогени)
Восьмигранний
-Гексафторид сірки, SF6
-Гексафторид селену, SeF6
-Гексафторфосфат, ПФ6-
Для завершення молекулярної геометрії пояснюються спостереження хімічних або фізичних властивостей речовини. Однак вона орієнтована за електронною геометрією, так що остання завжди повинна бути визначена перед першою.
Список літератури
- Уіттен, Девіс, Пек і Стенлі. Хімія (8-е изд.). CENGAGE Learning, стор 194-198.
- Shiver & Atkins. (2008). Неорганічна хімія (Четверте видання., Стор. 23, 24, 80, 169). Mc Graw Hill.
- Марк Е. Такерман. (2011). Молекулярна геометрія та теорія VSEPR. Отримано з: nyu.edu
- Віртуальний Chembook, Чарльз Е. Опардт. (2003). Введення в молекулярну геометрію. Отримано з: chemistry.elmhurst.edu
- Хімія LibreTexts. (8 вересня 2016 року). Геометрія молекул. Отримано з: chem.libretexts.org


