Хімічна структура, властивості та застосування берилієвого гідриду (BeH2)
The гідрид берилію являє собою ковалентное з'єднання, утворене між лужноземельним металом берилію і водню. Його хімічна формула - BeH2, і, будучи ковалентним, він не складається з іона Be2+ Н-. Це, разом з LiH, один з найлегших металевих гідридів, здатних синтезуватися.
Його отримують шляхом обробки диметилберилом, Be (CH3)2, з алюмогідридом літію, LiAlH4. Проте, БЕ2 Найчистіше отримують піролізом ді-трет-бутилберилію, Be (C (CH3)3)2 при 210 ° С.

Як індивідуальна молекула в газоподібному стані вона лінійна в геометрії, але в твердому і рідкому стані вона полімеризується в масивах тривимірних мереж. Він є аморфним твердим речовиною в нормальних умовах і може стати кристалічним і проявляти металеві властивості під величезним тиском.
Вона являє собою можливий спосіб зберігання водню або як джерело водню при розкладанні, або у вигляді твердого поглинаючого газу. Проте, БЕ2 Він дуже токсичний і забруднюючий, враховуючи високу поляризацію берилію.
Індекс
- 1 Хімічна структура
- 1.1 Молекула BeH2
- 1.2 Ланцюги BeH2
- 1.3 Тривимірні мережі BeH2
- 2 Властивості
- 2.1 Ковалентний характер
- 2.2 Хімічна формула
- 2.3 Фізичний вигляд
- 2.4 Розчинність у воді
- 2.5 Розчинність
- 2.6 Щільність
- 2.7 Реактивність
- 3 Використання
- 4 Посилання
Хімічна структура
Молекула BeH2
На першому зображенні видно окрему молекулу гідриду берилію в газоподібному стані. Зауважимо, що його геометрія лінійна, причому атоми Н відокремлені один від одного на кут 180º. Щоб пояснити таку геометрію, атом Be повинен мати sp гібридизацію.
Берилій має два валентні електрони, які знаходяться в орбітальній 2s. Згідно з теорією валентних зв'язків, один з електронів 2s орбіталі енергетично просувається до орбіталі 2p; і як наслідок, він може тепер утворювати дві ковалентні зв'язки з двома sp гібридними орбіталями.
А як щодо інших вільних орбіталей Бі? Дві інші чисті 2p орбіталі є доступними, негибридизованними. З ними порожні, БЕХ2 це дефіцит сполуки електронів у газовій формі; і тому, охолоджуючи і групуючи свої молекули, вони конденсуються і кристалізуються в полімері.
BeH Chains2
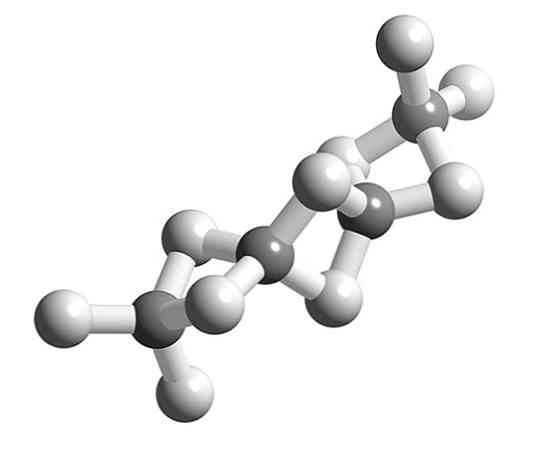
При молекул БеХ2 полімеризуючи, навколишню геометрію атома Be перестає бути лінійною і стає тетраедричною.
Раніше структуру цього полімеру моделювали так, ніби вони були ланцюгами з одиницями BeH2 пов'язані водневими мостами (верхнє зображення, зі сферами білого і сірого тонів). На відміну від водневих зв'язків диполь-дипольних взаємодій вони мають ковалентний характер.
У мосту Be-H-Be полімеру два електрони розподілені між трьома атомами (посилання 3c, 2e), які теоретично повинні бути розташовані швидше навколо атома водню (тому що він більш електронегативний).
З іншого боку, Be оточений чотирма H вдається заповнити відносно свою електронну вакансію, завершивши свій валентний октет.
Тут теорія валентних зв'язків падає, щоб дати відносно точне пояснення. Чому? Тому що водень може мати тільки два електрони, а -Х-ланка передбачає участь чотирьох електронів.
Отже, пояснити мости Be-H2-Be (дві сірі сфери, пов'язані двома білими сферами) потребують інших складних моделей зв'язку, таких як ті, що забезпечуються теорією молекулярної орбіти..
Експериментально встановлено, що полімерна структура BeH2 Це не дійсно ланцюжок, а тривимірна мережа.
Тривимірні мережі BeH2
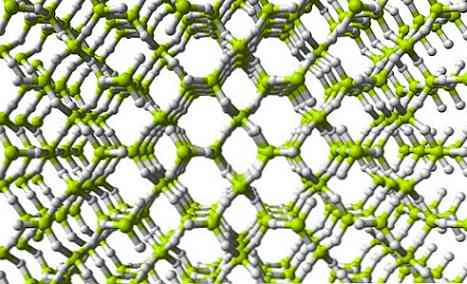
На верхньому зображенні показаний розріз тривимірної мережі BeH2. Зауважимо, що жовтувато-зелені сфери, атоми Be, утворюють тетраедр, як у ланцюзі; однак у цій структурі є більша кількість водневих мостів, і, крім того, структурний блок вже не є BeH2 але BeH4.
Ті ж БЕ структурні одиниці2 і BeH4 вони вказують на те, що в мережі є більша кількість атомів водню (4 атома Н для кожного Be).
Це означає, що берилію в цій мережі вдається заповнити свою електронну вакансію навіть більше, ніж у структурі полімеру, подібного до ланцюга..
І як найбільш очевидну відмінність цього полімеру по відношенню до окремої молекули BeH2, полягає в тому, що Be має обов'язково мати sp гібридизацію3 (Зазвичай) для пояснення тетраедричної і нелінійної геометрії.
Властивості
Ковалентний характер
Чому гідрид берилію є ковалентним і неіонним з'єднанням? Гідриди інших елементів групи 2 (Mr. Becamgbara) є іонними, тобто вони складаються з твердих речовин, утворених катіоном М.2+ і два гідридних аніона H- (MgH2, CaH2, BaH2). Тому БЕ2 Вона не складається з Be2+ Н- взаємодіють електростатично.
Катіон Be2+ вона характеризується високою поляризаційною силою, яка спотворює електронні хмари навколишніх атомів.
В результаті цього спотворення H аніони- вони змушені утворювати ковалентні зв'язки; посилання, які є наріжним каменем тільки що пояснених структур.
Хімічна формула
BeH2 або (BeH2) n
Зовнішній вигляд
Безбарвне аморфне тверде речовина.
Розчинність у воді
Це виходить з ладу.
Розчинність
Нерозчинні в діетиловому ефірі і толуолі.
Щільність
0,65 г / см3 (1,85 г / л). Перше значення може відноситися до газової фази, а друге - до полімерного твердого речовини.
Реактивність
Реагує повільно з водою, але швидко гідролізується HCl з утворенням берилію хлориду, BeCl2.
Гідрид берилію реагує з основами Льюїса, конкретно триметиламіном, N (CH)3)3, з утворенням димерного аддукту, з мостиковими гідридами.
Також він може реагувати з диметиламіном з утворенням тримерного діаміду берилію, [Be (N (CH3)2)2]3 і водень. Реакція з гідридом літію, де іон H- є основою Льюїса, утворюють послідовно LIBeH3 і Лі2BeH4.
Використання
Гідрид берилію може представляти собою перспективний спосіб зберігання молекулярного водню. Розкладаючи полімер, він вивільняє H2, яка буде слугувати ракетним паливом. З цього підходу тривимірна мережа зберігала б більше водню, ніж ланцюги.
Також, як видно на зображенні мережі, є пори, які дозволяють розміщувати молекули Н.2.
Насправді, деякі дослідження моделюють те, що фізичне зберігання буде, як у BeH2 кристалічний тобто полімер, підданий величезним тискам, і які б були його фізичні властивості при різних кількостях адсорбованого водню.
Список літератури
- Вікіпедія. (2017). Берилій гідрид. Отримано з: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Теорета. Чим. Acta (1979) Електронні структури полімерного гідриду берилію та полімерного гідриду бору. 51: 163. doi.org/10.1007/BF00554099
- Глава 3: Берилій гідрид та його олігомери. Отримано з: shodhganga.inflibnet.ac.in
- Вікас Наяк, Суман Бангер і У. П. Верма. (2014). Дослідження структурного та електронного поведінки BeH2 як з'єднання для зберігання водню: підхід Ab Initio. Конференції в науці, вип. 2014, Артикул 807893, 5 сторінок. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Неорганічна хімія В Елементах групи 1. (Четверте видання). Mc Graw Hill.


