Властивості, реактивність і застосування кальцієво-гідридних (CaH2)
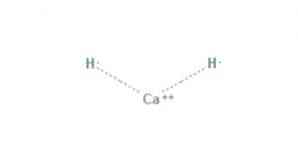
The гідрид кальцію є хімічною сполукою формули CaH2, що робить його гідридом лужноземельних. Ця хімічна сполука має дві іонні зв'язки між кальцієм і двома гідридними іонами, як показано на малюнку 1.
Це сольовий гідрид, що означає, що його структура схожа на сіль. Його кристалічна структура та ж сама, що і хлорид свинцю (Cotunnite mineral), як показано на малюнку 2.

Всі лужні і лужноземельні метали утворюють гідридні солі. У хімії гідрид являє собою водень-аніон, H- або, більш часто, з'єднання, в якому один або кілька центрів водню мають нуклеофільні, відновні або основні властивості.
У сполуках, які вважаються гідридами, атом водню приєднаний до більш електропозитивному елементу або групі.
Він може бути отриманий шляхом взаємодії кальцію і водню при температурі від 300 до 400 градусів Цельсія. Іншим способом приготування гідриду кальцію є нагрівання хлориду кальцію разом з воднем і металом натрію. Реакція відбувається наступним чином:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
У цій реакції кальцій (Ca) і водень (H) створюють молекулу гідриду кальцію, тоді як атоми натрію разом з хлором створюють молекули хлориду натрію (NaCl).
Гідрид кальцію також може бути отриманий шляхом зменшення оксиду кальцію (CaO) магнієм (Mg). Реакцію проводять у присутності водню. Ця реакція також продукує оксид магнію (MgO). Нижче наведена формула для цієї хімічної реакції:
CaO + Mg + H2 → CaH2 + MgO
Індекс
- 1 Фізико-хімічні властивості гідриду кальцію
- 2 Реактивність і небезпека
- 3 Обробка та зберігання
- 4 Використання та застосування
- 4.1 Осушувач
- 4.2 Виробництво водню
- 4.3 Зменшуючий агент
- 5 Недолік у використанні гідриду кальцію
- 6 Посилання
Фізико-хімічні властивості гідриду кальцію
Гідрид кальцію являє собою набір кристалів з білою орторомбічною структурою, коли він є чистим. Як правило, рідко зустрічається в такому вигляді, тому зазвичай має сіруватий відтінок. У ньому відсутній характерний запах. Його вигляд показаний на малюнку 3 (Королівське хімічне товариство, 2015).

Вона має молекулярну масу 42,094 г / моль, має температуру плавлення 816 градусів Цельсія і щільність 1,70 г / мл. Якщо він розчиняється у воді, він реагує насильно, виробляючи водень. Він також реагує з алкоголем (Національний центр біотехнологічної інформації., С.Ф.).
Реактивність і небезпека
Гідрид кальцію є стабільною хімічною речовиною, хоча він високо реактивний до води або вологи. При контакті з водою він випускає горючий газ, який може спонтанно запалюватися.
Вона вважається вибуховою речовиною. При нагріванні в реакції з тетрагідрофураном він може викликати вибух. При змішуванні з хлоратом, гіпохлоритом, броматом, перхлоратом калію він стає чутливим до тепла, тертя і стає вибухонебезпечним (Calcium Hydride 7789-78-8, 2016).
Коли фторид срібла подрібнюють гідридом кальцію, маса стає лампами розжарювання. Сильне нагрівання гідриду хлором, бромом або йодом призводить до розжарювання.
Суміші гідриду з різними броматами, наприклад, бромат барію або хлорати, наприклад хлорат барію і перхлорати, такі як перхлорат калію, вибухають при розтиранні. CaH2 реагує з розжарюванням з фторидом срібла, якщо він піддається тертю.
Ця сполука повинна бути оброблена в інертній атмосфері. Якщо їх не обробляти належним чином, це може становити серйозну загрозу здоров'ю та безпеці персоналу лабораторії, рятувальників та хімічних відходів (центр лабораторної безпеки УЦ, 2013).
Надзвичайно небезпечний у разі контакту зі шкірою або очима, оскільки він дратує. Дуже небезпечний при контакті з шкірою, оскільки він може бути корозійним.
Вона також небезпечна в разі проковтування і вдихання. Кількість пошкодження тканини залежить від довжини контакту. Контакт з очима може призвести до пошкодження рогівки або сліпоти.
Контакт зі шкірою може викликати запалення і пухирі. Вдихання пилу призведе до подразнення шлунково-кишкового або дихального тракту, що характеризується печінням, чханням і кашлем..
Важке перенасичення може спричинити пошкодження легенів, удушення, втрату свідомості і навіть смерть. Запалення очей характеризується почервонінням, подразненням і свербінням. Запалення шкіри характеризується свербінням, лущенням, почервонінням або іноді бульбашками.
Повторне вплив очей на низький рівень може викликати подразнення очей. Повторне вплив на шкіру може викликати місцеве руйнування шкіри або дерматит.
Повторне вдихання пилу може призвести до різного ступеня подразнення дихання або пошкодження легенів. Повторне або тривале вдихання пилу може спричинити хронічне подразнення дихальних шляхів (Паспорт безпеки матеріалу ГСМ кальцію, 2005).
У разі контакту з очима їх слід негайно промити великою кількістю води протягом принаймні 15 хвилин, іноді піднімаючи верхню і нижню повіки..
У разі контакту зі шкірою слід негайно промити великою кількістю води протягом щонайменше 15 хвилин при видаленні забрудненого одягу та взуття.
У разі прийому всередину блювоту не слід індукувати. Слід назвати центр контролю отруй. Бажано негайно виїхати з виставкового центру та переїхати на вулицю.
У разі інгаляції, якщо дихання ускладнене, необхідно подавати кисень. Дихання з рота в рот не слід призначати, якщо потерпілий потрапив у організм або вдихав речовину.
Штучне дихання слід індукувати за допомогою кишенькової маски, оснащеної односпрямованим клапаном або іншим відповідним медичним пристроєм дихання. У всіх випадках необхідно негайно отримати медичну допомогу.
Обробка та зберігання
З'єднання слід зберігати в сухому контейнері подалі від тепла. Його слід тримати подалі від джерел займання. Не вдихайте пил. До цього продукту не слід додавати води
У разі недостатньої вентиляції носити відповідне дихальне обладнання, таке як фільтрувальна маска. У разі впливу слід звернутися за медичною допомогою та показати етикетку якомога більше. Уникайте контакту зі шкірою та очима.
Вогненебезпечні матеріали, як правило, слід зберігати в окремому шафі безпеки або приміщенні для зберігання. Зберігайте контейнер щільно закритим.
Зберігати в прохолодному і добре провітрюваному місці. Все обладнання, що містить матеріал для уникнення електричних іскр, має бути заземлено. Контейнер слід зберігати в сухому місці і в прохолодному місці.
Це негорючий матеріал. Однак пожежники повинні носити відповідне обладнання при гасінні пожежі навколо цього хімічного з'єднання.
Ніколи не рекомендується використовувати воду для гасіння вогню навколо гідриду кальцію. Для цього можна використовувати сухий пісок, а також такі сполуки, як хлорид натрію і карбонат натрію.
Для видалення відходів кальцієвого гідриду його необхідно розкласти шляхом додавання 25 мл метанолу на кожен грам гідриду в атмосфері азоту при перемішуванні.
Після завершення реакції до водної сполуки метоксиду кальцію додають такий же об'єм води, який вивантажують у сток великою кількістю води (National Research Council, 1995)..
Використання та застосування
Осушувач
Гідрид калію є відносно м'яким осушувачем. З цієї причини використання цього з'єднання в якості осушувача є більш безпечним у порівнянні з більш реакційноздатними агентами, такими як металеві сплави натрій-калій і натрій. Реагує з водою наступним чином:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Продукти гідролізу цієї реакції, водень (газ) і Ca (OH) 2 (водна суміш), можуть бути відокремлені від хімічного розчинника після фільтрації, дистиляції або процесу декантації..
Це хімічне з'єднання є ефективним осушувачем для багатьох основних розчинників, таких як аміни і піридин. Іноді його використовують для попереднього висушування розчинників перед використанням більш реактивних осушувачів.
Виробництво водню
У 1940-х роках це з'єднання було доступне як джерело водню під торговою назвою "Hydrolith".
Він використовувався як джерело водню протягом тривалого часу. Він як і раніше використовується для виробництва чистого водню в лабораторіях для різних експериментів, сучасних паливних елементів та застосувань акумуляторів (American Elements, S.F.).
З'єднання широко використовувалося протягом десятиліть як безпечний і зручний засіб роздування повітряних кульок.
Крім того, він регулярно використовується в лабораторіях для виробництва невеликих кількостей високочистого водню для експериментів. Вміст вологи дизельного палива розраховується за воднем, отриманим після обробки CaH2.
Відновник
При нагріванні між 600 і 1000 градусами Цельсія оксид цирконію, ніобій, уран, хром, титан, ванадій і тантал можна зменшити для приготування порошку цих металів, так що гідрид кальцію може бути використаний в металургії пилу.
Наступна реакція ілюструє спосіб, в якому гідрид кальцію діє як відновник:
TiO + 2CaH2 → CaO + H2 + Ti
Недолік при використанні гідриду кальцію
Ця хімічна сполука часто є кращим вибором в якості сушильного агента; Проте, він також має деякі недоліки:
-Дія сушіння цього з'єднання є повільною, оскільки вона не розчиняється в будь-якому розчиннику, з яким він не реагує бурхливо.
-Це порошкове з'єднання є несумісним з багатьма розчинниками. Ваша реакція з хлоркарбонами може навіть викликати вибухи.
-Він не може бути використаний для деоксигенирования розчинників, оскільки він не здатний усунути розчинений кисень.
-Диференціювання між гідридом кальцію і гідроксидом кальцію є досить складним через його аналогічний вигляд.
Список літератури
- Американські елементи. (S.F.). гідрид кальцію. Отримано з americanelements.com: americanelements.com.
- Гідрид кальцію 7789-78-8. (2016). Отримано з chemicalbook.com: chemicalbook.com.
- гідрид кальцію. (s.f.). Отримано з навчального курсу хімії: chemistrylearner.com.
- Паспорт безпеки матеріалу Гідрид кальцію MSDS. (2005, 10 жовтня). Отримано з sciencelab.com: sciencelab.com.
- Національний центр біотехнологічної інформації. (S.F.). База даних PubChem Compound; CID = 105052. Отримано з pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- національна наукова рада. (1995). Розсудливі практики в лабораторії: обробка та утилізація хімічних речовин. Washinton: NationalAcademy Press.
- Королівське хімічне товариство. (2015). гідрид кальцію ID 94784. Витяг з chemspider.com: chemspider.com.
- UC центр лабораторної безпеки. (2013, 18 січня). стандартна робоча процедура гідрид кальцію. Отримано з chemengr.ucsb.edu: chemengr.ucsb.edu.


