Формула гідриду магнію, хімічна структура і властивості
The гідрид магнію (MgH2 молекулярної формули), являє собою хімічну сполуку з вмістом у вазі водню 7,66%, і зустрічається в природі у вигляді білого кристалічного твердого речовини. Вона використовується в основному для приготування інших хімічних речовин, хоча вона також вивчена як потенційна середовище зберігання для водню.
Він належить до сімейства сольових (або іонних) гідридів, які визначаються H-іонами, негативно зарядженими. Ці гідриди вважаються такими, що утворюються з лужних металів і лужноземельних металів, але у випадку магнію (і берилію) мають ковалентні зв'язки, крім тих іонів, які характеризують дане сімейство гідридів.
Індекс
- 1 Підготовка та формула
- 2 Хімічна структура
- 3 Фізико-хімічні властивості
- 3.1 Фізична
- 3.2 Хімічні речовини
- 4 Використання
- 4.1 Зберігання водню
- 4.2 Реакції гідрування і дегідрування
- 4.3 Бруд
- 4.4 Паливні елементи
- 4.5 Транспорт та енергетика
- 4.6 Алкилювання
- 5 Ризики
- 5.1 Реакція з водою
- 5.2 Він є пірофорним
- 6 Посилання
Підготовка та формула
Гідрид магнію утворюється шляхом прямого гідрування магнію (Mg) металу в умовах високого тиску і температури (200 атмосфер, 500 ° С) з каталізатором MgI2. Його реакція еквівалентна:
Mg + H2→ MgH2
Досліджено також виробництво MgH2 при більш низьких температурах з використанням нанокристалічного магнію, виробленого в кульових млинах.
Існують також і інші способи приготування, але вони являють собою більш складні хімічні реакції (гідрування магнію-антрацену, реакція між диэтилмагнезием з літій-алюмінієвим гідридом, а також продукт комплексу MgH).2).
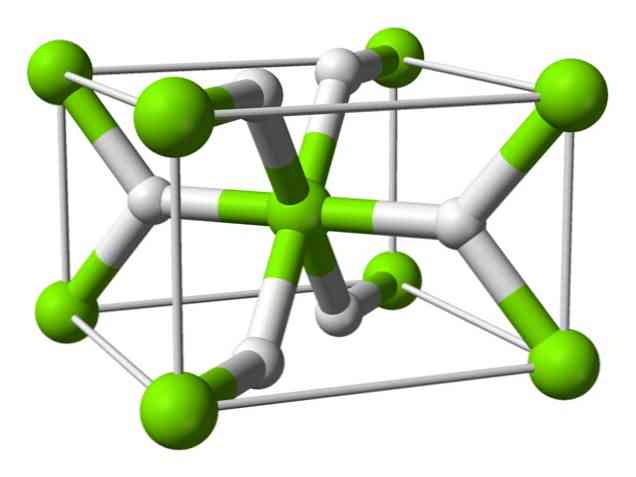
Хімічна структура
Цей атом має структуру рутилу при кімнатній температурі з тетрагональною кристалічною структурою. Він має принаймні чотири різні форми в умовах високого тиску, а також спостерігається нестехіометрична структура з дефіцитом водню; останній відбувається тільки в дуже малих кількостях частинок при утворенні.
Як згадувалося вище, зв'язки, які існують у структурі рутилу, мають частково ковалентні властивості, замість того, щоб бути чисто іонними, як і інші сольові гідриди.
Це призводить до того, що атом магнію має сферичну форму, повністю іонізовану, але її гідридний іон має витягнуту структуру.
Фізико-хімічні властивості
Фізичний
- Зовнішній вигляд: Білі кристали.
- Молярна маса: 26,3209 г / моль
- Щільність: 1,45 г / см3
- Точка плавлення: 285 ° С розкладається
- Розчинність: У воді розкладається.
Ця хімічна сполука має молекулярну масу 26,321 г / моль, щільність 1,45 г / см3 і має температуру плавлення 327 ° С..
Хімічні речовини
- Прекурсор для виробництва інших хімічних речовин.
- Зберігання водню, як можливий джерело енергії.
- Відновник у органічному синтезі.
Важливо вказати, що це з'єднання не може бути доведено до рідкого стану, а коли його переносять або його температуру плавлення або вводять у воду, він розкладається. Цей гідрид є нерозчинним в ефірі.
Він є високореактивним і легкозаймистим речовиною, а також пірофорним, тобто він може спонтанно запалюватися в повітрі. Ці три умови представляють ризики для безпеки, які будуть згадані в останньому розділі цієї статті.
Використання
Зберігання водню
Гідрид магнію легко реагує з водою для утворення газоподібного водню через наступну хімічну реакцію:
MgH2+2H2O → 2H2+Mg (OH)2
Крім того, ця речовина розкладається при температурі 287 ° С і тиску 1 бар наступним чином:
MgH2→ Mg + H2
Тому було запропоновано використання гідриду магнію як середовища для зберігання водню для його використання та транспортування.
Запропоновано гідрування і дегідрування кількості металевого магнію в якості способу транспортування кількостей газоподібного водню, таким чином забезпечуючи відсутність витоку в його транспортуванні і представляючи більш безпечний і практичний спосіб, ніж при використанні посудин високого тиску..
Реакції гідрування і дегідрування
Хоча температура розкладання гідриду магнію є обмежувальним фактором для його використання, запропоновані методи для поліпшення кінетики реакцій гідрування і дегідрування. Одним з них є зменшення розміру магнієвої частки з використанням кульових млинів.
Бруд
Крім того, була запропонована система, яка виробляє гідрид магнію у вигляді бурового розчину (більш керованого і безпечного, ніж у порошку або інших твердих частинках), які реагують з водою для отримання бажаного водню.
Передбачається, що раніше названий шлам буде утворений тонко подрібненим гідридом, захищеним захисним шаром масел і суспендованих в диспергуючих агентах, щоб гарантувати, що він зберігає свою консистенцію без втрати матеріалу і що він не вбирає вологу з навколишнього середовища..
Цей шлам має ту перевагу, що він може перекачуватися через будь-який звичайний дизельний, бензиновий або водяний насос, роблячи цю економічну пропозицію, а також ефективну.
Паливні елементи
Гідрид магнію може бути реалізований у виробництві передових паливних елементів, а також у створенні батарей і накопичення енергії.
Транспорт і енергія
Протягом останніх десятиліть розглядалося використання водню як джерела енергії. Імплантація водню в якості палива вимагає знаходження безпечних і оборотних систем зберігання і з високими об'ємними потужностями (кількість водню на одиницю об'єму) і гравіметричним (кількість водню на одиницю маси).
Алкілування
Алкілування (додавання CH алкільних груп3R) органічних сполук в основному середовищі, де присутні групи -OH при низьких концентраціях і температурах, що перевищують температуру плавлення гідриду.
У цьому випадку водні атоми, присутні в гідриді магнію (MgH2), з'єднують групи -OH, утворюючи воду. Вільний магній може отримувати галоген, який часто супроводжує молекулу алкілу, яка призначена для зв'язування з вуглеводневої ланцюгом..
Ризики
Реакція з водою
Як вже зазначалося, гідрид магнію є речовиною, яка дуже легко і насильно реагує з водою, що дає можливість вибухати при більш високих концентраціях.
Це відбувається тому, що його екзотермічна реакція генерує достатню кількість тепла, щоб запалити газ, що виділяється при реакції розкладання, що призводить до досить небезпечної ланцюгової реакції..
Він пірофорний
Гідрид магнію також є пірофорним, що означає, що він може самозайматися в присутності вологого повітря і утворює оксид магнію і воду..
Її вдихання не рекомендується в твердому стані або в контакті з його парами: речовина в природному стані та продукти розкладання можуть викликати серйозні травми або навіть смерть..
Він може генерувати корозійні розчини в контакті з водою і забруднення його. Контакт зі шкірою і очима не рекомендується, а також викликає подразнення слизових оболонок.
Не було продемонстровано, що гідрид магнію може генерувати хронічні наслідки для здоров'я, такі як рак, репродуктивні дефекти або інші фізичні чи психічні наслідки, але рекомендується використовувати захисні засоби (особливо респіратори або маски) характер дрібного пилу).
При роботі з цією речовиною вологість повітря повинна зберігатися на низьких рівнях, гасити всі джерела займання і транспортувати її в барабанах або інших контейнерних контейнерах..
Завжди слід уникати роботи з великими концентраціями цієї речовини, коли її можна уникнути, оскільки можливість вибуху істотно знижується.
Якщо відбувається розливання гідриду магнію, робочу зону слід ізолювати, а пил збирати пилососом. Ви ніколи не повинні використовувати метод сухого підмітання; збільшує шанси реакції з гідридом.
Список літератури
- Zumdahl, S.S. (1998). Енциклопедія Британіка. Взяті з britannica.com.
- PubChem. (2005). Відкрийте базу даних хімії PubChem. Взяті з pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Конгрес зелених автомобілів. Взяті з greencarcongress.com.
- Хімічні речовини, C. (n.d.). Cameo хімічних речовин. Взяті з cameochemicals.noaa.gov.
- Services, N.J. (1987). Міністерство охорони здоров'я та старших служб Нью-Джерсі. Взяті з nj.gov.


