Формула стронцій-гідриду, характеристики, властивості, застосування
The гідрид стронцію (SrH2) це молекула, яка утворюється з атомом стронцію (Sr) в центрі і двома атомами водню, що супроводжують його. Він також відомий як дигідрид стронцію.
Формула, що визначає цю сполуку, є SrH2. Оскільки стронцій є дуже великим атомом порівняно з двома атомами водню, і з-за його розподілу генерується молекула з дипольним моментом, рівним нулю..
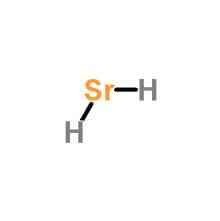
Це означає, що його геометрія дорівнює прямій, що заряди розподілені однаково і тому вона неполярна, і що вона може бути змішана з молекулами тієї ж природи, як двоокис вуглецю (CO2)..
Особливості
Будучи гідридом, реакції окислення і відновлення можуть бути зроблені з цією сполукою.
Крім того, коли водень взаємодіє з водою, у твердому стані утворюються газоподібний водень (H2) і гідроксид стронцію Sr (OH) 2.
Цей гідроксид стронцію використовують при рафінуванні цукру і в якості добавки в пластмасах для стабілізації його структури.
Крім того, внаслідок своєї природної афінності він здатний поглинати полярні гази, такі як діоксид вуглецю, щоб утворити тверді речовини, такі як карбонат стронцію..
Ці два сполуки можуть бути злоякісними для здоров'я, якщо є безпосереднє вплив на них, оскільки вони подразнюють шкіру, очі і дихальну систему.
У разі контакту без захисту необхідно звернутися до лікаря для проведення контролю за станом здоров'я.
Властивості
Вона має молекулярну масу 89,921 г / моль, з яких 87 г / моль представляють стронцій і решту водню. Його формальний заряд дорівнює нулю, тому він не є електричним агентом.
Він має хорошу спорідненість з неполярними речовинами, прикладами яких є діоксид вуглецю та похідні вуглеводнів, такі як метан.
Завдяки своїй вазі, при утворенні зв'язків з деякими газами, кінцевий продукт призводить до отримання твердої речовини.
Використання
Гідрид стронцію не широко використовується, оскільки його властивості можуть бути легко замінені іншими сполуками з більшою доступністю, ніж стронцій.
Якщо знайдено багате джерело цього з'єднання, його можна використовувати для взаємодії з водою і утворювати дигідроксид стронцію, який використовується в цукровій промисловості та пластмасах як добавки..
Незважаючи на те, що вони не добре відомі, в дослідженні вона використовується з певною вибірковістю, особливо в органічній хімії важких агентів, в дослідженнях енергетичного балансу, термодинаміки, лазерів, спектрів світла..
Використання хімічних сполук ґрунтується на їхніх хімічних і механічних властивостях, однак одним з найважливіших факторів для встановлення цих застосувань є уява людини і технічна спроможність людини, яка її використовує..
Важливо мати знання не тільки про природу елементів, але й про всі фундаментальні поняття, що існують в природі з такими дисциплінами, як математика, фізика, хімія та біологія..
Список літератури
- Simon, P., Moroshkin, P., Weller, L., Saß, A., & Weitz, M. (2013). До перерозподілу лазерного охолодження молекулярних газів: Виробництво кандидатних молекул SrH лазерною абляцією. Папір, представлений на , 8638 doi: 10.1117 / 12.2002379
- Peterson, D.T., & Nelson, S.O. (1980). рівноважні тиски водню в стронцій-водневій системі. Журнал менш поширених металів, 72(2), 251-256. doi: 10.1016 / 0022-5088 (80) 90144-7
- Shayesteh, A., Walker, K.A., Gordon, I., Appadoo, D.R.T., & Bernath, P.F. (2004). Нові спектри Фур'є інфрачервоного випромінювання CaH і SrH: комбіновані ізотопні аналізи з CaD і SrD. Журнал молекулярної структури, 695, 23-37. doi: 10.1016 / j.molstruc.2003.11.001
- Ober, J. A. (2016). стронцію. Mining Engineering, 68 (7), 72-73.
- Kichigin, O. (2006). Вивчення полімерних хелатируючих сорбентів з о-аміноазо-о-гідроксихелатирующими групами та їх використання для концентрування та вилучення стронцію з природних, питних та промислових вод. Журнал аналітичної хімії, 61 (2), 114-118. doi: 10.1134 / S1061934806020043


