Закон Рауля, в якому він складається, позитивні і негативні відхилення
The Закон Рауля був запропонований французьким хіміком Франсуа-Марі Раултом у 1887 році і служить для пояснення поведінки тиску пари розчину двох змішуваних речовин (зазвичай ідеальних) в залежності від часткового тиску пари кожного компонента, присутнього в цьому.
Існують закони хімії, які використовуються для опису поведінки речовин в різних умовах і пояснюють явища, в яких вони беруть участь, використовуючи науково обгрунтовані математичні моделі. Закон Рауля є одним з них.

Використовуючи пояснення, засноване на взаємодії між молекулами газів (або рідин) для прогнозування поведінки тиску пари, цей закон використовується для дослідження неідеальних або реальних рішень за умови, що для коригування моделі розглядаються необхідні коефіцієнти. Математичний і пристосовувати його до неідеальних умов.
Індекс
- 1 З чого він складається??
- 2 Позитивні та негативні відхилення
- 2.1 Позитивні відхилення
- 2.2 Негативні відхилення
- 3 Приклади
- 3.1 Основна суміш
- 3.2 Бінарна суміш з нелетким розчиненим речовиною
- 4 Посилання
З чого вона складається??
Закон Рауля базується на припущенні, що відповідні рішення ведуть себе ідеально: це відбувається тому, що цей закон базується на ідеї, що міжмолекулярні сили між різними молекулами є такими ж, як і між аналогічними молекулами ( насправді це не так успішно).
Насправді, чим ближче рішення до ідеальності, тим більше можливостей йому доведеться дотримуватися характеристик, запропонованих цим законом..
Цей закон пов'язує тиск парів розчину з нелетким розчиненим речовиною, стверджуючи, що він буде дорівнює тиску пари такого чистого розчиненої речовини при цій температурі, помноженої на його молярну частку. Це виражається математичними термінами для одного компонента наступним чином:
Pi = Pºi . Xi
У цьому вираженні Pi дорівнює парціальному тиску парів компонента i в газовій суміші, Pºi - тиск парів чистого компонента i і Xi - мольна частка компонента i в суміші.
Таким же чином, коли у розчині є кілька компонентів і вони досягли стану рівноваги, можна розрахувати загальний тиск парів розчину, поєднавши закон Рауля з Дальтоном:
P = PºAXA + PºBXB + PºCXc...
Крім того, у тих розчинах, де присутні тільки одна розчинена речовина і розчинник, закон може бути сформульований, як показано нижче:
PA = (1-XB) x PºA
Позитивні і негативні відхилення
Рішення, які можуть бути досліджені за допомогою цього закону, повинні нормально поводитися в ідеалі, оскільки взаємодії між їх молекулами малі і дозволяють припустити однакові властивості у всьому рішенні без винятку..
Проте ідеальні рішення практично не існують, тому в розрахунки, що представляють міжмолекулярні взаємодії, необхідно включити два коефіцієнти. Це коефіцієнт імпульсності і коефіцієнт активності.
У цьому сенсі відхилення щодо закону Рауля визначаються як позитивні або негативні, залежно від результатів, отриманих в той час.
Позитивні відхилення
Позитивні відхилення відносно закону Рауля виникають, коли тиск пари розчину більше, ніж розраховано за законом Рауля.
Це відбувається, коли сили когезії між подібними молекулами перевищують однакові сили між різними молекулами. У цьому випадку обидва компоненти випаровуються легше.
Це відхилення видно в кривій тиску пари як максимальна точка в конкретному складі, утворюючи позитивний азеотроп.
Азеотроп є рідкою сумішшю двох або більше хімічних сполук, які поводяться так, ніби вона утворена єдиним компонентом і випаровується без зміни складу..
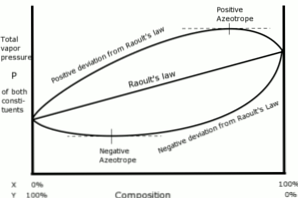
Негативні відхилення
Негативні відхилення від закону Рауля виникають, коли тиск пари суміші нижче, ніж очікувалося після розрахунку із законом.
Ці відхилення з'являються, коли сили когезії між молекулами суміші більше, ніж середні сили між частинками рідини в їх чистому стані..
Цей тип відхилення генерує утримання кожного компонента в рідкому стані силами притягання, більшими, ніж сили речовини в чистому стані, так що частковий тиск парів системи зменшується.
Негативні азеотропи в кривих тиску пари представляють мінімальну точку і демонструють спорідненість між двома або більше компонентами, що беруть участь у суміші..
Приклади
Закон Рауля зазвичай використовується для розрахунку тиску розчину на основі його міжмолекулярних сил, порівнюючи розрахункові значення з реальними значеннями, щоб зробити висновок, чи є якісь відхилення, і якщо це повинно бути позитивним або негативним. Нижче наведено два приклади використання закону Рауля:
Основна суміш
Наступна суміш, що складається з пропану і бутану, являє собою наближення тиску пари, і можна припустити, що обидва компоненти знаходяться в рівних пропорціях всередині неї (50-50), при температурі 40 ° С:
Xпропан = 0,5
Pºпропан = 1352,1 кПа
Xбутан = 0,5
Pºбутан = 377,6 кПа
Він розраховується за законом Рауля:
Pсуміш = (0,5 x 377,6 кПа) + (0,5 x 1352,1 кПа)
Отже:
Pсуміш = 864,8 кПа
Бінарна суміш з нелетким розчиненим речовиною
Іноді буває, що розчинена речовина суміші є нелетучою, тому закон використовується для розуміння поведінки тиску пари.
Дана суміш води і цукру в пропорціях 95% і 5% відповідно, при нормальних температурних умовах:
Xводи = 0,95
Pºводи = 2,34 кПа
Xцукру = 0,05
Pºцукру = 0 кПа
Він розраховується за законом Рауля:
Pсуміш = (0,95 х 2,34 кПа) + (0,05 х 0 кПа)
Отже:
Pсуміш = 2,22 кПа
Очевидно, що спостерігається зниження тиску водяної пари через вплив міжмолекулярних сил.
Список літератури
- Anne Marie Helmenstine, P. (s.f.). Визначення закону Рауля. Отримано з thoughtco.com
- ChemGuide. (s.f.). Закон Рауля і нелетучі розчини. Отримано з chemguide.co.uk
- LibreTexts. (s.f.). Закон Рауля і ідеальні суміші рідин. Отримано з chem.libretexts.org
- Нейтріум. (s.f.). Закон Рауля. Отримано з neutrium.net
- Вікіпедія. (s.f.). Закон Рауля. Отримано з en.wikipedia.org


