Формула сульфату натрію, властивості, структура, застосування
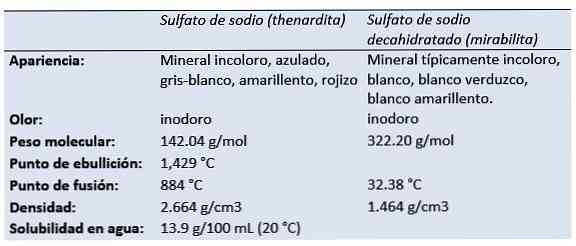
The сульфат натрію (динатрієва сіль сірчаної кислоти, динатрію тетраоксидосульфат, сульфат соди, сіль глаубера, теардит, мірабіліт) є неорганічним з'єднанням з формулою Na2SO4 і пов'язані з ним гідрати. Всі форми є білими твердими речовинами, які добре розчиняються у воді.
Вона вважається одним з основних хімічних продуктів, що продаються. Його виробництво в усьому світі (майже виключно у формі декагідрату) становить приблизно 6 мільйонів тонн на рік.

Тонардіт - це безводний мінерал сульфату натрію, який виробляється в аридних випаровувальних середовищах, в сухих печерах, у старих гірничих роботах, як вицвітання, і як родовище біля фумаролів.
Вперше він був описаний в 1825 році в Салінас Еспартінас (Ciempozuelos, Мадрид, Іспанія) і був названий тотардіта на честь французького хіміка Луї Жака Тенара (1777-1826).

Голландський / німецький хімік і аптекар Йоганн Рудольф Глаубер (1604-1670) виявив у 1625 році у воді австрійського джерела дегідрид сульфату натрію (пізніше відомий як сіль Глаубера). Він називав його мірабіліс сіллю (чудотворною сіллю), завдяки своїм лікувальним властивостям.
У період між 1650 і 1660 р. Glauber почав виробляти сульфат натрію з солі (NaCl) і концентрованої сірчаної кислоти. Цей процес розглядається як початок хімічної промисловості.
Його кристали використовувалися як послаблююче до 20-го століття.
У вісімнадцятому столітті почалася реакція глауберової солі з калієм (карбонат калію) у промисловому виробництві кальцинованої соди (карбонат натрію).

В даний час використовується в основному для виробництва миючих засобів і в крафт-процесі для виробництва паперової маси (домінуючим методом у виробництві паперу).
Родовища мінералів сульфату натрію знаходяться в США, Канаді, Іспанії, Італії, Туреччині, Румунії, Мексиці, Ботсвані, Китаї, Єгипті, Монголії та Південній Африці..
Основними виробниками є Китай (провінції Цзянсу і Сичуань), за нею йде Іспанія, де розташований найбільший в світі глауберитовий родовище (у Серезо-де-Ріо-Тірон, Бургос)..
Загальний обсяг світового виробництва природного сульфату натрію оцінюється в 8 мільйонів тонн, а отриманий як побічний продукт інших промислових процесів від 2 до 4 млн. Тонн.
В Іспанії, за інформацією, опублікованою в Національній інвентаризації сульфатних натрієвих ресурсів та інших оновлених даних, оцінювалися запаси мінералів сульфату натрію порядку 730 млн. Т. В каталозі як "резерви", а 300 млн. Тонн - як "інші ресурси".
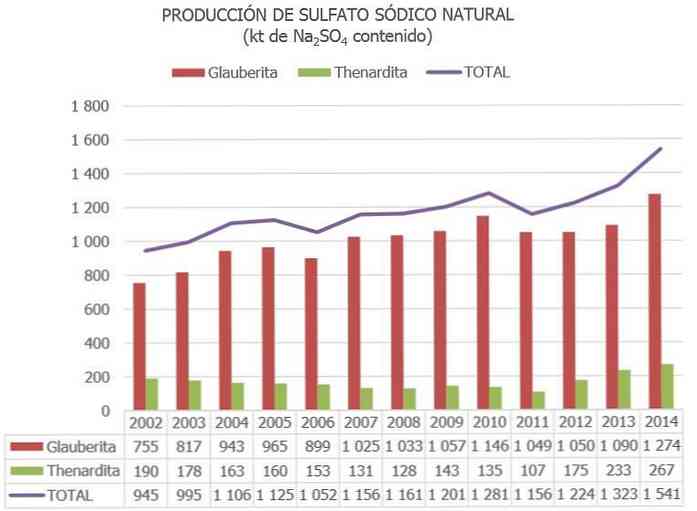
В Європейському Союзі Іспанія в даний час є єдиною країною з рудами сульфату натрію (головним чином з Тардардіт, Глауберит і Мірабіліт).
В даний час спостерігається загальний спад попиту на сульфат натрію в текстильному секторі.
В останні роки в деяких регіонах інші галузі, такі як миючі засоби, зазнали певного зростання через низьку ціну в якості сировини.
Основні розширюються ринки миючих засобів сульфату натрію знаходяться в Азії, Центральній Америці та Південній Америці.
Формули

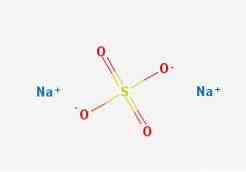
2D-структура
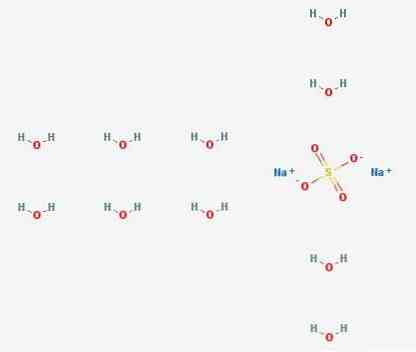
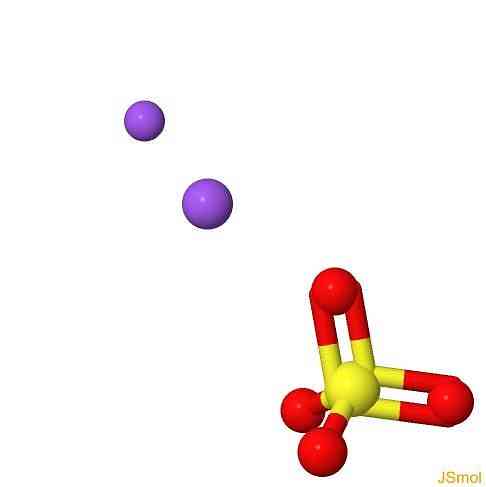
3D-структура
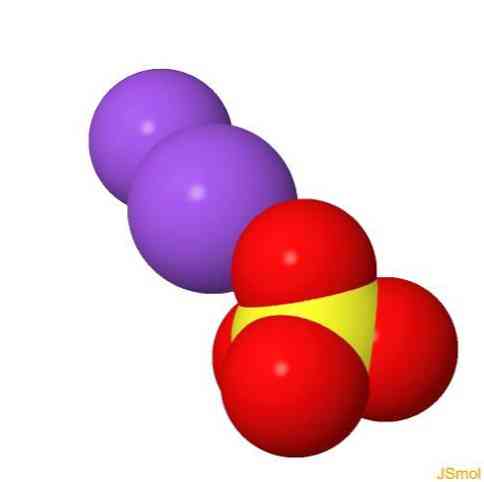
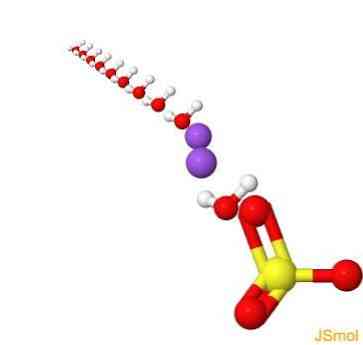
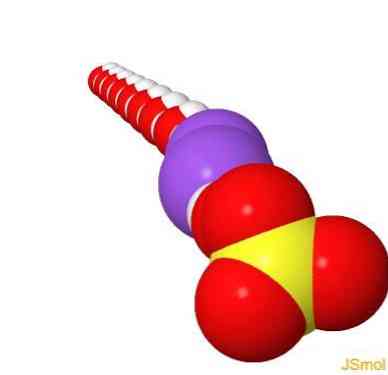
Особливості
Фізико-хімічні властивості
Сульфат натрію відноситься до реактивної групи сполук натрію, а також відноситься до групи сульфатів, гідросульфатів і дисульфітів.
Займистість
Це негорюча речовина. Немає ризику вибуху його порошків.
Реактивність
Сульфат натрію дуже розчинний у воді і гігроскопічний. Він дуже стабільний, не реактивний щодо більшості окислювальних або відновлювальних агентів при нормальних температурах. При високих температурах він може бути перетворений в сульфід натрію шляхом карботермічного зниження.
Хімічно нереактивні речовини вважаються нереактивними в типових умовах навколишнього середовища (хоча вони можуть реагувати в порівняно екстремальних умовах або в каталізі). Вони стійкі до окислення і відновлення (за винятком екстремальних умов).
Небезпечні хімічні реакції
При розплавленні алюмінію з сульфатом натрію або калію відбувається сильний вибух.
Токсичність
Хімічно нереактивні речовини вважаються нетоксичними (хоча газоподібні речовини з цієї групи можуть діяти як задушливі речовини).
Хоча сульфат натрію, як правило, вважається нетоксичним, його необхідно обробляти обережно. Порошок може викликати астму або тимчасове роздратування очей. Цього ризику можна уникнути, якщо носити захист для очей і маску для паперу.
Використання
Її основні застосування полягають у виробництві:
- пральний порошок.
- паперова маса.
- текстиль.
- скло.
- синтез ферментів (виноробство).
- харчування людини і тварин.
- аптечні продукти.
- Основна хімія в цілому.
- сталевих процесів.
- Мийний порошок
Сульфат натрію - дуже дешевий матеріал. Найбільше його використання як наповнювач в побутових порошкових мийних засобах, що споживає прибл. 50% світового виробництва. Нові компактні або рідкі миючі засоби не включають сульфат натрію, тому це використання зменшується.
Ще одне застосування сульфату натрію, що зменшується, особливо в США. і Канади, знаходиться в крафт-процесі для виготовлення деревної маси. Досягнення теплової ефективності процесу, різко знизили потребу в сульфате натрію.
Скляна промисловість надає інше важливе застосування для сульфату натрію. Це друге місце в Європі. Сульфат натрію використовують для усунення невеликих бульбашок повітря з розплавленого скла.
У Японії найбільше застосування сульфату натрію йде у виробництві текстилю. Сульфат натрію допомагає барвникам проникати рівномірно в волокна і не роз'їдає посуд з нержавіючої сталі, що використовується при фарбуванні (на відміну від хлориду натрію, який є альтернативним способом).
Сульфат натрію особливо підходить для зберігання сонячного тепла низької якості (для подальшого випуску при нагріванні) завдяки високій ємності тепла під час зміни фази від твердого до рідкого, що дається при 32 ° C.
Для охолодження, суміш з кухонною соллю натрію (NaCl) знижує температуру плавлення до 18 ° C.
В лабораторії безводний сульфат натрію широко використовується як інертний сушильний агент, для видалення слідів води з органічних розчинів. Його дія є більш повільною, ніж у сульфату магнію, але вона може використовуватися з різними матеріалами, оскільки вона хімічно цілком інертна.
Декагідрат сульфату натрію (сіль Глаубера) історично використовувався як проносний засіб. Він ефективний для ліквідації деяких препаратів, таких як ацетамінофен (ацетамінофен) з організму після передозування.
До інших застосувань сульфату натрію можна віднести його застосування в якості добавки при виготовленні килимових освіжувачів повітря, як добавки в корм для тварин, і у виробництві крохмалю.
Клінічні ефекти
Для його терапевтичного застосування сульфат натрію відноситься до категорії фізіологічних розчинів і проносних проносних препаратів, що застосовуються при лікуванні запорів.
Фізіологічними засобами є солі, які зберігають рідини в кишечнику шляхом осмотичної дії неабсорбированной солі, що викликає непряме збільшення перистальтики..
Фізіологічні засоби слабко поглинаються шлунково-кишковим трактом, тому системна токсичність малоймовірна, якщо не потрапити масивні кількості. Проте великі експозиції можуть викликати дегідратацію та зміни електролітів, що є вторинними по відношенню до осмотичного ефекту сполуки.
Хронічне зловживання послаблюванням може відбуватися у пацієнтів з розладами харчової поведінки, синдромом Мюнхгаузена або фактичними розладами. Загалом, у пацієнтів спостерігається нудота, блювота та діарея, пов'язані з спазмами в животі. Важкі ефекти можуть включати дегідратацію, гіпотензію, гіпернатрію і порушення електроліту.
Безпека та ризики
Положення про небезпеку глобальної гармонізованої системи класифікації та маркування хімічних речовин.
Глобально гармонізована система класифікації та маркування хімічних речовин (МГЕ) є міжнародно узгодженою системою, створеною Організацією Об'єднаних Націй, призначеною для заміни різних стандартів класифікації та маркування, які використовуються в різних країнах шляхом використання послідовних глобальних критеріїв (ООН United, 2015).
Класи небезпеки (та їх відповідний розділ GHS), стандарти класифікації та маркування, а також рекомендації для сульфату натрію є такими (Європейське агентство з хімічних речовин, 2017, Організація Об'єднаних Націй, 2015, PubChem, 2017):
Класи небезпеки СГС
H315: Викликає подразнення шкіри [Увага! Корозія / подразнення шкіри - Категорія 2].
H317: Може викликати алергічну шкірну реакцію [Попереджувальна сенсибілізація, шкіра - категорія 1].
H319: Спричиняє серйозне подразнення очей [Увага! Серйозне ураження очей / подразнення очей - Категорія 2A].
H412: Шкідливий для водних організмів з тривалими несприятливими ефектами [Небезпека для водного середовища, довготривала небезпека - Категорія 3].
(PubChem, 2017)
Кодекси пруденційних рад
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 і P501.
Список літератури
- ChemIDplus (2017) 3D структура 7757-82-6 - безводний сульфат натрію [зображення]. Отримано з: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-структура 7727-73-3 - сульфат натрію [USP] [зображення]. Отримано з: chem.nlm.nih.gov.
- Dyet, D. (2007) Thatardite Сульфат натрію поблизу мінеральної округи Невада Sodaville [image] Витягнуто з: en.wikipedia.org.
- Європейське агентство з хімічних речовин (ECHA), (2017). Резюме класифікації та маркування. Гармонізована класифікація - Додаток VI до Регламенту (ЄС) № 1272/2008 (Регламент CLP). Сульфат натрію.
- Grumetisho (2012) Mirabilita [image] Отримано з: es.wikipedia.org.
- Банк даних про небезпечні речовини (HSDB). TOXNET (2017). Сульфат натрію Bethesda, MD, EU: Національна медична бібліотека. Отримано з: toxnet.nlm.nih.gov.
- Інститут геології та гірництва Іспанії (IGME) (2016). ГЛАУБЕРІТА-ТЕНАРДІТА (ПРИРОДНИЙ СУЛЬФАТ НАТРІЮ) 2014. Панорама видобутку. Отримано з: igme.es.
- Національний інститут безпеки праці (ІНШТ). (2010). Міжнародні хімічні записи безпеки. Сульфат натрію. Міністерство праці та безпеки. Мадрид ES Отримано з: insht.es.
- Langbein Rise (2008) Безперервна крафт-целюлоза [image] Отримано з: wikimedia.org.
- Організація Об'єднаних Націй (2015). Глобальна гармонізована система класифікації та маркування хімічних продуктів (РГА) Шосте переглянуте видання. Нью-Йорк, США: видання ООН. Отримано з: unece.org.
- Національний центр біотехнологічної інформації. PubChem Compound Database (2016) Сульфат натрію - Структура PubChem [image] Bethesda, MD, EU: Національна медична бібліотека. Отримано з: pubchem.ncbi.nlm.nih.gov.
- Національний центр біотехнологічної інформації. База даних PubChem Compound (2016) Сульфат натрію - Структура PubChem [image] Bethesda, MD, EU: Національна бібліотека медицини.
- Національний центр біотехнологічної інформації. База даних PubChem Compound. (2017). Натрій сульфат декагідратований. Bethesda, MD, EU: Національна медична бібліотека. Отримано з: pubchem.ncbi.nlm.nih.gov.
- Національний центр біотехнологічної інформації. База даних PubChem Compound. (2017). Сульфат натрію Bethesda, MD, EU: Національна медична бібліотека. Отримано з: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Натрій сірчанокислий [image] Отримано з: wikimedia.org.
- Вікіпедія (2017) Крафт-процес. Отримано з: wikipedia.org.
- Вікіпедія (2017) Mirabilita. Отримано з: wikipedia.org.
- Вікіпедія (2017) Mirabilite. Отримано з: wikipedia.org.
- Вікіпедія (2017) Сульфат натрію. Отримано з: wikipedia.org.
- Вікіпедія (2017) Solfato di deacidrate натрію. Отримано з: https://it.wikipedia.org.
- Вікіпедія (2017) Сульфат натрію. Отримано з: wikipedia.org.
- Wikipedia (2017) Отримано з: wikipedia.org.
- Вікіпедія (2017). Отримано з: .wikipedia.org.


