Властивості сульфіду міді, ризики та застосування
The сульфіди міді описують сімейство хімічних сполук і мінералів з формулою CuxSі. Ці сполуки складаються з економічно важливих мінералів і синтетичних матеріалів.
Найбільш помітними мінералами мідного сульфіду є сульфід міді (I) або сульфід міді хімічної формули.2S міститься в мінералі кальцину та сульфіду міді (II) або сульфіду міді, у формулі CuS, що міститься в ковелітному мінералі.
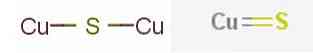
Калькозин видобувається століттями і є однією з найбільш прибуткових мідних руд. Причинами цього є високий вміст міді (атомне співвідношення 67% і майже 80% ваги) і легкість, з якою мідь може бути відокремлена від сірки.
Однак він не є головним мідним мінералом через його дефіцит. Незважаючи на те, що найбагатші нафтові відкладення були видобуті, це, ймовірно, все ще видобувається і, безумовно, буде видобуватися в майбутньому (MINERAL CHALCOCITE, 2014).

Ковліт не є розподіленим мінералом, але його переливаючі принади можуть заволодіти захопленням тих, хто бачить кристали індиго-блакитного кольору. Хоча хороші кристали рідкісні, це блиск і колір цього мінералу робить його чудовим (THE MINERAL COVELLITE, 2014).

У гірничодобувній промисловості мінерали борніту або халькопіриту, які складаються з змішаних сульфідів міді та заліза, часто називають "сульфідами міді".
У хімії "двійковий сульфід міді" являє собою будь-яке бінарне хімічне з'єднання елементів міді і сірки. Незалежно від джерела, сульфіди міді широко варіюють за складом 0,5 ≤ Cu / S ≤ 2, включаючи численні нестехіометричні сполуки..
Індекс
- 1 Фізико-хімічні властивості сульфідів міді
- 2 Реактивність і небезпека
- 3 Використання
- 4 Посилання
Фізико-хімічні властивості сульфідів міді
Сульфід міді (I) і (II) мають схожий вигляд, будучи як кристалами темними, сірими або чорними.

Ці сполуки можуть бути диференційовані за їх кристалічною структурою. Сульфід міді (I) має моноклінну структуру, тоді як сульфід міді (II) має гексагональну структуру (Національний центр біотехнологічної інформації, С.Ф.).
Вони мають молекулярну масу 159,16 г / моль і 95,611 г / моль і щільність 5,6 г / мл і 4,76 г / мл для випадку сульфіду міді (I) і (II) відповідно (Національний центр Біотехнологічна інформація, SF).
Сульфід міді (I) має температуру плавлення 1100 ° С і нерозчинний у воді і оцтовій кислоті, частково розчинний у гідроксиді амонію (Royal Society of Chemistry, 2015).
Сульфід міді (II) має температуру плавлення 220 ° С, де він розкладається, нерозчинний у воді, соляній та сірчаній кислоті і розчинний у азотній кислоті, гідроксиді амонію та ціаніді калію (Королівське хімічне товариство, 2015 р.) ).
Перекис водню енергійно реагує з сульфідом міді (II) і вибухає при контакті з концентрованим розчином хлорної кислоти або хлоратів кадмію, магнію або цинку.
Реактивність і небезпека
Сульфіди міді (I) і (II) не класифікуються як небезпечні, однак вони можуть бути токсичними при попаданні в організм внаслідок виробництва сірководню. Симптоми включають блювоту, біль у шлунку та запаморочення, можуть викликати подразнення шкіри та очей, а вдихання може викликати подразнення в дихальних шляхах (МАТЕРІАЛЬНА ЛИСТКА БЕЗПЕКИ, 1995).
У випадку впливу тепла, він може вивільнити токсичні пари сірки або оксиду міді, які можуть бути шкідливими для здоров'я.
У разі контакту з очима їх слід негайно промити достатньою кількістю води протягом 15 хвилин, зрідка піднімаючи нижню і верхню повіки.
У разі контакту зі шкірою негайно промити достатньою кількістю води протягом 15 хвилин, знявши забруднений одяг..
У разі прийому всередину слід негайно викликати центр боротьби з отрутою. Промийте рот холодною водою і дайте потерпілому 1-2 склянки води або молока, щоб випити. Блювота повинна бути негайно індукована.
У разі інгаляції потерпілого слід відвести в прохолодне місце. Якщо не дихає, дайте штучне дихання (мідь (II) Sulfide, 2009).
Використання
Сульфід міді (I) використовується як напівпровідник і в фотографічних додатках (американськіелементи, 1998-2017). Його застосування також включає використання в сонячних батареях, світлових фарбах, електродах і деяких сортах твердих мастильних матеріалів (Britannica, 2013).
З іншого боку, сульфід міді (II) знаходить застосування в сонячних елементах, суперіонних провідниках, фотоприймачах, електропровідних електродах, фототермічних перетворювальних пристроях, мікрохвильових захисних покриттях, активних поглиначів радіохвиль, газових сенсорах і поляризаторах інфрачервоний (azom, 2013).
Також у дослідженні наночастинок використовується сульфід міді (II) (ковеліт):
- З різними виробничими процедурами (сольвотермічні шляхи, аерозольні методи, методи розчинення та термоліз)
- І застосування (фотокаталітична деградація, абляція ракових клітин, матеріал електродів в літій-іонних батареях і газовий датчик, властивості польових випромінювань, застосування суперконденсаторів, фотоелектрохімічні характеристики QDSC, фотокаталітичне відновлення органічних забруднювачів, біо- електрохімічне виявлення, поліпшені характеристики PEC попередньо приготовлених плівкових електродів CuS) (Umair Shamraiz, 2016).
У роботі Geng Ku (2012) продемонстровано використання напівпровідникових наночастинок сульфіду міді (CuS NPs) для візуалізації фотоакустичних томографій з Nd: YAG лазером на довжині хвилі 1064 нм..
CuS NP дозволив візуалізувати мозок миші після внутрішньочерепної ін'єкції, лімфатичні вузли щурів на 12 мм нижче шкіри після інтерстиціальної ін'єкції і агарозний гель, що містить CuS NP, вбудований в м'яз курячої грудки. на глибині ~ 5 см. Цей підхід має великий потенціал для отримання молекулярного зображення раку молочної залози.
Список літератури
- (1998-2017). Сульфід міді (I). Отримано з americanelements.com.
- (2013, 19 квітня). Сульфідні міді (CuS) Напівпровідники. Отримано з azom.com.
- Britannica, Т. Е. (2013, 23 серпня). Мідь (Cu). Отримано з britannica.com.
- Сульфід міді (II). (2009, 23 січня). Отримано з onboces.org.
- Geng Ku, M. Z. (2012). Наночастинки сульфіду міді як новий клас фотоакустичного контрастного агента для глибокої тканинної візуалізації при 1064 нм. ACS Nano 6 (8), 7489-7496.
- МАТЕРІАЛЬНА ЛИСТКА БЕЗПЕКИ Сульфат міді. (1995, листопад). Отримано з onboces.org.
- Національний центр біотехнологічної інформації. (S.F.). База даних PubChem Compound; CID = 14831. Отримано з pubchem.ncbi.nlm.nih.gov.
- Національний центр біотехнологічної інформації. (S.F.). База даних PubChem Compound; CID = 62755. Отримано з pubchem.ncbi.nlm.nih.gov.
- Королівське хімічне товариство. (2015). Мідний (II) сульфід. Отримано з chemspider.com.
- Королівське хімічне товариство. (2015). Сульфід (1+). Отримано з chemspider.com.
- МІНЕРАЛЬНИЙ ХАЛКОЦИТ. (2014). Отримано з galleries.com.
- МІНЕРАЛЬНИЙ КОВЕЛЛІТ. (2014). Отримано з galleries.com.
- Умайр Шамрас, Р. А. (2016). Виготовлення та застосування наноструктур сульфіду міді (CuS). Журнал хімії твердого тіла Том 238, 25-40.


