Формули сульфіду натрію, застосування, ризики
The сульфіду натрію (Na2S) являє собою кристалічну тверду речовину від жовтого до цегляно-червоного. У природі вона зустрічається в різних ступенях гідратації, будучи найпоширенішим нонагідрат сульфіду натрію (Na2S · 9H2O).
Це водорозчинні солі, які дають сильно лужні розчини. Під впливом вологого повітря вони поглинають вологу з повітря, яка може спонтанно нагріватися і викликати займання навколишніх горючих матеріалів. Крім того, при контакті з вологим повітрям вони виділяють сірководень, який пахне як гнилі яйця.

Вони є сильними відновниками. Ці речовини можуть бути небезпечними для навколишнього середовища, особливо для водних організмів.
Моносульфід натрію комерційно доступний у вигляді пластівців, що містять 60-62% Na2S ...
- Формули

- CAS: 1313-82-2 Сульфід натрію (безводний)
- CAS: 1313-84-4 Сульфід натрію
2D-структура
3D-структура
Характеристики сульфіду натрію
Фізико-хімічні властивості

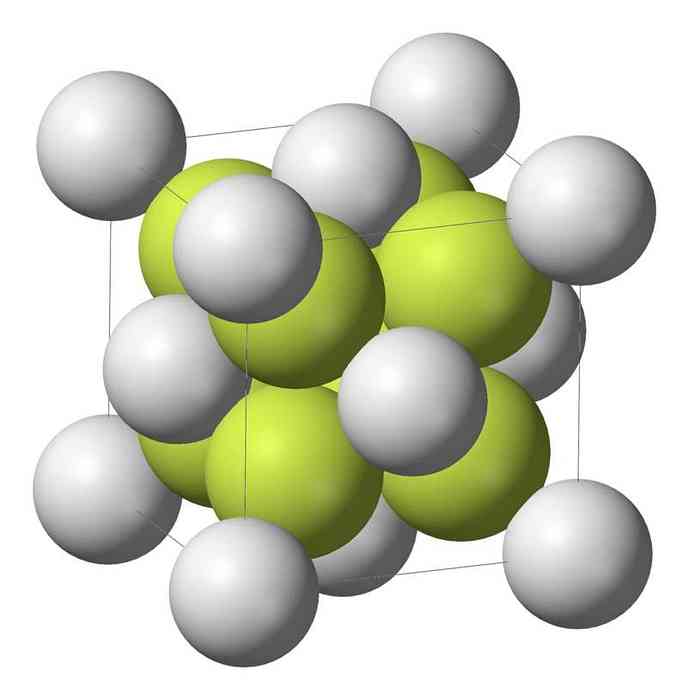
Моносульфід натрію (Na2S) кристалізується з антифлюоритовою структурою, в якій кожен S-атом оточений кубом з 8 атомів Na і кожного атома Na тетраедричним з 4 атомів S..
Займистість
Єдиним легкозаймистим членом у групі неорганічних сульфідів є сірководень. Однак деякі інші неорганічні сульфіди, такі як сульфід натрію, можуть спонтанно нагріватися і навіть запалюватися при дії вологи..
При дії вогню сульфід натрію виділяє гази або пари діоксиду сірки, які є дратівливими або токсичними.
Реактивність
- Неорганічні сульфіди, як правило, є основними (деякі з них є сильноосновними і тому несумісні з кислотами).
- Багато з цих сполук є відновлювальними агентами (вони енергійно реагують з окислювальними агентами).
- Прості солі сульфідів (такі як натрій, калій і сульфід амонію) енергійно реагують з кислотами для виділення високотоксичного і легкозаймистого газу сірководню.
- Сульфід натрію є горючим. Може швидко вибухнути при швидкому нагріванні або ударі.
- При нагріванні до розкладання він виділяє токсичні пари оксидів натрію і оксидів сірки.
- Бурхливо реагує з вуглецем, з вугіллям, солями діазонію, N, N-дихлорметиламіном, сильними окислювачами і водою.
Токсичність
Багато членів групи неорганічних сульфідів ведуть себе як сильні основи і можуть викликати сильні опіки, коли вони вступають в контакт зі шкірою.
Це властивість залежить від його розчинності. Найбільш нерозчинні неорганічні сульфіди (наприклад, сульфід ртуті (II) і сульфід кадмію) не є їдкими.
Сульфід натрію має середовище коефіцієнта розподілу октанол / вода (Pow) (-3,5). Це значення використовується як міра розчинності (і біоконцентрації) речовини в жирових тканинах тварин (особливо водних тварин).
Сульфід натрію вважається небезпечним для навколишнього середовища, особливо для водних організмів.
Використання
В домашніх умовах сульфід натрію використовується для розкриття труб, побутових очищувачів (для печі, ванної кімнати), випрямлячів для волосся, мильного посуду та автоподушок.
У промисловості він використовується в очисниках, в цементі, і в якості попередника у виробництві інших хімічних продуктів.
Клінічні ефекти
Вплив сульфіду натрію є поширеним у розвинених країнах і країнах з низьким рівнем розвитку, як у промисловості, так і вдома. Ці корозійні речовини присутні в декількох побутових виробах в низькій концентрації.
У розвинених країнах серйозні наслідки зустрічаються рідко. Вони відбуваються в основному внаслідок навмисного вживання хімікатом у дорослих. Однак у країнах, що розвиваються, серйозні наслідки є більш поширеними.
Лужні корозійні речовини викликають некроз внаслідок зрідження. Омилюють жири в клітинній мембрані, руйнуючи клітку і даючи можливість глибокого проникнення в тканини слизових оболонок.
Оральна експозиція
Початкове запалення відбувається в шлунково-кишковій тканині з подальшим некрозом тканин (з можливістю перфорації), потім грануляцією і, нарешті, формуванням стенозу..
Пацієнти з легким проковтуванням розвивають подразнення або опіки I ступеня (поверхневу гіперемію і набряк) ротоглотки, стравоходу або шлунка.
Пацієнти з помірною інтоксикацією можуть розвинути опіки II ступеня (поверхневі пухирі, ерозії та виразки) з можливим подальшим утворенням стенозу (особливо стравоходу)..
У деяких пацієнтів (особливо у маленьких дітей) може розвинутися набряк у верхніх дихальних шляхах.
Пацієнти з вираженою інтоксикацією при вживанні можуть розвивати глибокі опіки і некроз слизової оболонки шлунково-кишкового тракту, з ускладненнями, такими як: перфорація (стравохідна, шлункова, рідше дуоденальна), утворення свищів (трахеозофагеальная, аортезофагеальна) і шлунково-кишкові кровотечі.
Вони можуть розвиватися: гіпотензія, тахікардія, тахіпное, формування стриктури (головним чином стравоходу), рак стравоходу і набряки верхніх дихальних шляхів (що є поширеним і часто небезпечним для життя).
Сильне отруєння, як правило, обмежується навмисним прийомом у дорослих.
Вплив шляхом інгаляції
Легке вплив може викликати кашель і бронхоспазм.
Сильне вдихання може спричинити набряк верхніх дихальних шляхів, опіки, стридори і, рідше, гострі пошкодження легенів.
Експозиція очей
Це може призвести до важкого подразнення кон'юнктиви і хемозу, дефектів епітелію рогівки, лімбічної ішемії, постійної втрати зору і при важких випадках перфорації..
Дермальний вплив
М'який вплив викликає подразнення і часткову товщину опіків. У пацієнтів з важкими опіками або шоком може виникнути метаболічний ацидоз.
Тривалий вплив або продукти з високою концентрацією можуть викликати загальну опік товщини.
Безпека та ризики
Положення про небезпеку глобальної гармонізованої системи класифікації та маркування хімічних речовин
Глобально гармонізована система класифікації та маркування хімічних речовин (МГЕ) є міжнародно узгодженою системою, створеною Організацією Об'єднаних Націй і призначеною для заміни різних стандартів класифікації та маркування, що використовуються в різних країнах, використовуючи відповідні критерії по всьому світу.
Класи небезпеки (та їх відповідний розділ GHS), стандарти класифікації та маркування та рекомендації щодо сульфіду натрію є такими (Європейське агентство з хімічних речовин, 2017, Організація Об'єднаних Націй, 2015, PubChem, 2017):







Список літератури
- Benjah-bmm27, (2006). Fluorite-unit-cell-3D-ionic [image] Отримано з: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Отримано з: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-структура 1313-82-2 - сульфід натрію [image] Витягнуто з: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-структура 1313-84-4 - Натрій сульфід [image] Витягнуто з: chem.nlm.nih.gov.
- Європейське агентство з хімічних речовин (ECHA). (2017). Резюме класифікації та маркування.
- Гармонізована класифікація - Додаток VI до Регламенту (ЄС) № 1272/2008 (Регламент CLP). Сульфід натрію. Отримано 16 січня 2017 року, з: echa.europa.eu.
- Європейське агентство з хімічних речовин (ECHA). (2017). Резюме класифікації та маркування.
- Повідомлення про класифікацію та маркування. Сульфід натрію, гідратований. Отримано 16 січня 2017 року, з: echa.europa.eu.
- Банк даних про небезпечні речовини (HSDB). TOXNET (2017). Сульфід натрію. Bethesda, MD, EU: Національна медична бібліотека. Отримано з: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Сульфіди, полісульфіди та сульфани. У енциклопедії промислової хімії Ульмана. Wiley-VCH Verlag GmbH & Co. Отримано з dx.doi.org.
- Організація Об'єднаних Націй (2015). Глобальна гармонізована система класифікації та маркування хімічних продуктів (РГА) Шосте переглянуте видання. Нью-Йорк, США: видання ООН. Отримано з: unece.org.
- Національний центр біотехнологічної інформації. База даних PubChem Compound. (2016). Сульфід натрію enneahydrate - структура PubChem [image] Отримано з: pubchem.ncbi.nlm.nih.gov.
- Національний центр біотехнологічної інформації. База даних PubChem Compound. (2017). Моносульфід натрію. Bethesda, MD, EU: Національна медична бібліотека. Отримано з: pubchem.ncbi.nlm.nih.gov.
- Національний центр біотехнологічної інформації. База даних PubChem Compound. (2017). Сульфід натрію. Bethesda, MD, EU: Національна медична бібліотека. Отримано з: pubchem.ncbi.nlm.nih.gov.
- Національне управління океаніки і атмосфери (NOAA). CAMEO Chemicals. (2017). Хімічні дані. Сульфід натрію, безводний. Silver Spring, MD. ЄС; Отримано з: cameochemicals.noaa.gov.
- Національне управління океаніки і атмосфери (NOAA). CAMEO Chemicals. (2017). Реактивні дані групи. Сульфіди, неорганічні. Silver Spring, MD. ЄС; Отримано з: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Отримано з: wikipedia.org.
- PubChem, (2016). Моносульфід натрію [зображення] Отримано з: puchem.nlm.nih.gov.
- PubChem, (2016). Сульфід натрію enneahydrate [зображення] Отримано з: puchem.nlm.nih.gov.
- Вікіпедія. (2017). Коефіцієнт розподілу октанол-вода. Отримано 17 січня 2017 року, з: wikipedia.org.
- Вікіпедія. (2017). Сульфід натрію. Отримано 17 січня 2017 року, з: wikipedia.org.


