Структура, властивості, номенклатура, застосування сульфідного срібла (Ag2S)
The сульфід срібла являє собою неорганічне з'єднання, хімічна формула якого є Ag2S. Він складається з чорно-сіруватої твердої речовини, утвореної катионами Ag+ і аніони S2- у співвідношенні 2: 1. S2- це дуже схоже на Ag+, тому що обидва є м'якими іонами і їм вдається стабілізуватися один з одним.
Срібні прикраси, як правило, темніють, втрачаючи характерний блиск. Зміна кольору не є продуктом окислення срібла, а його реакції з сірководнем, присутнім в середовищі при низьких концентраціях; Це може бути результатом гниття або деградації рослин, тварин або продуктів, багатих сіркою.

H2S, молекула якого несе атом сірки, реагує зі сріблом за наступним хімічним рівнянням: 2Ag (s) + H2S (g) => Ag2S (s) + H2(g)
Тому Ag2S відповідає за чорні шари, сформовані на сріблі. Однак у природі цю сірку можна зустріти і в мінералах акантиту і аргентиту. Ці два мінерали відрізняються від багатьох інших своїми чорними і яскравими кристалами, подібними до тіла твердого у верхньому зображенні.
Ag2S представляє поліморфні структури, привабливі електронні та оптоелектронні властивості, є напівпровідником і обіцяє бути матеріалом для розробки фотоелектричних пристроїв, таких як сонячні елементи.
Індекс
- 1 Структура
- 2 Властивості
- 2.1 Молекулярна маса
- 2.2 Зовнішній вигляд
- 2.3 Запах
- 2.4 Точка плавлення
- 2.5 Розчинність
- 2.6 Структура
- 2.7 Індекс заломлення
- 2.8 Діелектрична проникність
- 2.9 Електроніка
- 2.10 Реакція відновлення
- 3 Номенклатура
- 3.1 Систематика
- 3.2 Запас
- 3.3 Традиційний
- 4 Використання
- 5 Посилання
Структура
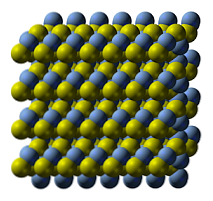
Кристалічна структура сульфіду срібла проілюстрована на верхньому зображенні. Сині сфери відповідають катионам+, а жовті - до аніонів S2-. Ag2S є поліморфним, що означає, що він може приймати кілька кристалічних систем при певних температурних умовах.
Як? Через фазовий перехід. Іони переставляються таким чином, що підвищення температури і коливання твердого тіла не порушують рівновагу електростатичного притягання-відштовхування. Коли це відбувається, говориться, що існує фазовий перехід, і тому тверде тіло має нові фізичні властивості (такі як блиск і колір)..
Ag2S при нормальних температурах (нижче 179ºC) має моноклінну кристалічну структуру (α- Ag2S). Крім цієї твердої фази є ще два: ОЦК (кубічний центризований в тілі) від 179 до 586ºC, і fcc (кубічний центрирований в гранях) при дуже високих температурах (δ- Ag).2S).
Аргентитний мінерал складається з ГЦК-фази, також відомої як β-Ag2Після охолодження і перетворення в обрив їх структурні особливості переважають у поєднанні. Отже, обидві кристалічні структури співіснують: моноклінна і ОЦК. Отже, виникають чорні тіла з яскравими і цікавими обертонами.
Властивості
Молекулярна маса
247,80 г / моль
Зовнішній вигляд
Кристали сірувато-чорні
Запах
Туалет.
Точка плавлення
836ºC. Це значення узгоджується з тим, що Ag2S є сполукою з малим іонним характером і, отже, плавиться при температурі нижче 1000ºC.
Розчинність
У воді всього 6.21. 10-15 г / л при 25ºC. Тобто, кількість чорного твердого речовини, солюбилизированного, є незначним. Це, знову ж таки, пов'язано з невеликим полярним характером зв'язків Ag-S, де немає істотної різниці електронегативності між обома атомами..
Також, Ag2S є нерозчинним у всіх розчинниках. Жодна молекула не може ефективно розділяти свої кристалічні шари в іонах Ag+ і S2- сольватированний.
Структура
Чотири шари S-Ag-S зв'язків також можна бачити на зображенні структури, які переміщаються один над одним, коли тверде тіло піддається розуміння. Така поведінка означає, що, незважаючи на те, що він є напівпровідником, він є пластичним, як і багато металів при кімнатній температурі.
Шари S-Ag-S підходять належним чином через їх кутову геометрію, яка спостерігається як зигзаг. Маючи силу розуміння, вони рухаються по осі переміщення, тим самим викликаючи нові нековалентні взаємодії між атомами срібла і сірки.
Індекс заломлення
2.2
Діелектрична проникність
6
Електроніка
Ag2S - амфотерний напівпровідник, тобто він поводиться так, наче він був такого типу n і типу стор. Він також не є крихким, тому його вивчали для застосування в електронних пристроях.
Реакція відновлення
Ag2S можна звести до металевого срібла шляхом купання чорних шматочків гарячою водою, NaOH, алюмінієм і сіллю. Відбувається наступна реакція:
3Ag2S (s) + 2Al (s) + 3H2O (l) => 6Ag (s) + 3H2S (ac) + Al2O3s
Номенклатура
Срібло, електронна конфігурація якого [Kr] 4d105s1, він може втратити тільки один електрон: зовнішній орбіталь 5s. Таким чином, Аг катіон+ залишається з електронною конфігурацією [Kr] 4d10. Тому вона має унікальну валентність +1, яка визначає, як її називати сполуками.
Сірка, з іншого боку, має електронну конфігурацію [Ne] 3s23п4, і вона потребує двох електронів для завершення свого валентного октету. Коли він отримує ці два електрони (зі срібла), він перетворюється в аніон сірки, S2-, з конфігурацією [Ar]. Тобто це ізоелектронний для аргону благородний газ.
Так що Ag2S слід називати відповідно до наступних номенклатур:
Систематика
Мавпасірка diсрібло Тут ми розглядаємо число атомів кожного елемента і вказуємо префіксами грецьких чисельників.
Запас
Сульфід срібла. Якщо має унікальну валентність +1, то не вказано римськими цифрами в дужках: сульфід срібла (I); що є неправильним.
Традиційний
Sulfuro argéntico. Оскільки срібло "працює" з валентністю +1, до його назви додається суфікс -ico argentum латинською мовою.
Використання
Деякі нові можливості для Ag2S такі:
-Окраски розчинів їх наночастинок (з різними розмірами), мають антибактеріальну активність, не є токсичними, і тому можуть бути використані в медицині та біології.
-Їх наночастинки можуть утворювати так звані квантові точки. Вони поглинають і випромінюють випромінювання з більшою інтенсивністю, ніж багато органічних флуоресцентних молекул, тому вони можуть витіснити останні як біологічні маркери.
-Структури α-Ag2S роблять його демонструючи вражаючі електронні властивості, які будуть використовуватися як сонячні елементи. Він також є відправною точкою для синтезу нових термоелектричних матеріалів і датчиків.
Список літератури
- Марк Пеплов. (17 квітня 2018). Напівпровідниковий сульфід срібла розтягується як метал. Взяті з: cen.acs.org
- Співпраця: Автори та редактори кристалічної структури III / 17E-17F-41C () Срібний сульфід (Ag2S). У: Madelung O., Rössler U., Schulz M. (eds) Нететраедрально пов'язані елементи і бінарні сполуки. Спрінгер, Берлін, Гейдельберг.
- Вікіпедія. (2018). Сульфід срібла. Взяті з сайту: en.wikipedia.org
- Садовников Станіслав Іванович (Липень 2016 року). Ag2S наночастинки сульфіду срібла і колоїдні розчини: Синтез і властивості. Взяті з: sciencedirect.com
- Азо-матеріали. (2018). Сульфід срібла (Ag2S) Напівпровідники. Взяті з: azom.com
- A. Nwofe. (2015). Перспективи та проблеми тонких плівок сульфіду срібла: огляд. Відділ матеріалознавства та відновлюваної енергетики, Департамент промислової фізики, Державний університет Ебонії, Абакалікі, Нігерія.
- UMassAmherst. (2011). Лекція Демонстрації: очищення заплямованого срібла. Взяті з: lecturedemos.chem.umass.edu
- Дослідження. (2018). Що таке Срібний Сульфід? - Хімічна формула і використання. Взяті з: study.com


