Основи, властивості та недоліки теорії морів електронів
The Електронна теорія електронів Це гіпотеза, яка пояснює виняткове хімічне явище, яке відбувається в металевих зв'язках між елементами з низькими електронегативностями. Йдеться про розподіл електронів між різними атомами, пов'язаними металевими зв'язками.
Електронна щільність між цими ланками така, що електрони ділокалізуються і утворюють «море», де вони вільно рухаються. Вона також може бути виражена квантовою механікою: деякі електрони (зазвичай від одного до семи на атом) розташовані в орбіталях з множинними центрами, які розтягнуті по поверхні металу..
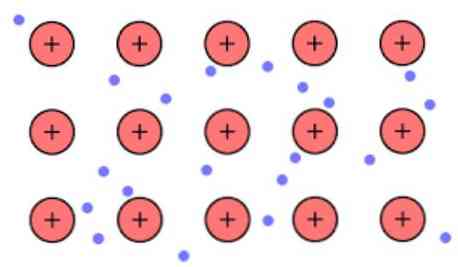
Крім того, електрони зберігають деяке розташування в металі, хоча ймовірнісний розподіл електронної хмари має більш високу щільність навколо деяких конкретних атомів. Це пов'язано з тим, що при застосуванні певного струму вони показують свою провідність в певному напрямку.
Індекс
- 1 Основи теорії моря електронів
- 2 Властивості
- 2.1 Зсув у вигляді шарів
- 2.2 Теорія моря електронів в металевих кристалах
- 3 Недоліки теорії
- 4 Посилання
Основи теорії моря електронів
Металеві елементи мають велику схильність до донорства електронів з їх останнього енергетичного рівня (валентного шару), завдяки їхній низькій енергії іонізації по відношенню до інших елементів..
Знаючи це, кожен металевий елемент можна вважати катіоном, пов'язаним з електроном останнього енергетичного рівня, який був би більш схильним до донорства..
Оскільки в металі у вас є велика кількість атомів, які пов'язані між собою, можна припустити, що цей метал утворює групу металевих катіонів, які занурені в своєрідне море валентних електронів, що мають велике офшорінг.
Враховуючи, що електростатичні сили тяжіння, які існують між катіоном (позитивним зарядом) і електроном (негативний заряд) мають сильно пов'язані атоми металу, він уявляє делокалізацію валентних електронів, що ведуть себе як електростатичний адгезив, який підтримує зв'язок до катіонів металів.
Таким чином, можна зробити висновок, що чим більше число електронів, наявних у валентному шарі металу, цей вид електростатичного клею буде мати більшу міцність.
Властивості
Теорія моря електронів пропонує просте пояснення характеристикам металевих видів, таких як опір, провідність, пластичність і пластичність, які змінюються від одного металу до іншого..
Виявлено, що стійкість до металів обумовлена великою ділокалізацією їх електронів, що генерує дуже високу силу когезії між атомами, що утворюють її.
Таким чином, пластичність відома як здатність деяких матеріалів допускати деформацію своєї структури, не даючи достатньо розбити, коли піддається певним силам.
Offshoring у вигляді шарів
Як пластичність, так і пластичність металу визначаються тим, що валентні електрони ділокалюються у всіх напрямках у вигляді шарів, що змушує їх рухатися один над одним під дією зовнішньої сили, запобігання руйнуванню металевої структури, але дозволяє її деформацію.
Крім того, свобода переміщення делокалізованих електронів дозволяє мати потік електричного струму, що робить метали дуже хорошою провідністю електрики.
Крім того, це явище вільного руху електронів дозволяє переносити кінетичну енергію між різними областями металу, що сприяє передачі тепла і викликає метали проявляти високу теплопровідність.
Теорія моря електронів в металевих кристалах
Кристали є твердими речовинами, які мають фізичні та хімічні властивості - такі як щільність, точка плавлення і твердість - які встановлюються тими силами, які роблять частинки, які змушують їх залишатися разом.
У певному сенсі вважається, що кристали металевого типу мають найпростіші структури, оскільки кожна "точка" кристалічної мережі зайнята атомом самого металу..
В цьому ж сенсі було визначено, що в основному структура кристалів металу кубічна і фокусується на гранях або тілі.
Однак ці види також можуть мати шестигранну форму і мати досить компактну упаковку, що дає їм таку величезну щільність, яка є характерною..
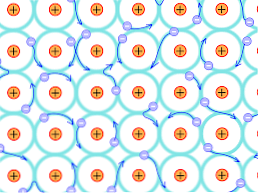
Завдяки цій структурній причині зв'язки, що утворюються в металевих кристалах, відрізняються від тих, що зустрічаються в інших видах кристалів. Електрони, які можуть утворювати зв'язки, делокалізуються по всій кристалічній структурі, як пояснено вище.
Недоліки теорії
У металевих атомах є невелика кількість валентних електронів пропорційно їх енергетичним рівням; тобто, є більша кількість доступних енергетичних станів, ніж кількість пов'язаних електронів.
Звідси випливає, що оскільки є сильна електронна делокалізація, а також енергетичні смуги, частково заповнені, електрони можуть рухатися через ретикулярну структуру, коли вони піддаються електричному полі, що надходить ззовні, крім формування океану електронів. що підтримує проникність мережі.
Отже, об'єднання металів інтерпретується як конгломерат позитивно заряджених іонів, пов'язаних морем електронів (негативно заряджених)..
Однак існують характеристики, які не пояснюються цією моделлю, такі як утворення певних сплавів між металами з певними композиціями або стабільність колективних металевих ланок, серед інших..
Ці недоліки пояснюються квантовою механікою, оскільки і ця теорія, і багато інших підходів були створені на основі найпростішої моделі одного електрона, намагаючись застосувати набагато складніші структури мультиелектронних атомів..
Список літератури
- Вікіпедія. (2018). Вікіпедія. Отримано з en.wikipedia.org
- Holman, J.S., and Stone, P. (2001). Хімія Отримано з books.google.co.ve
- Parkin, G. (2010). Зв'язування метало-металу. Отримано з books.google.co.ve
- Rohrer, G. S. (2001). Структура і зв'язування в кристалічних матеріалах. Отримано з books.google.co.ve
- Ibach, H., і Lüth, H. (2009). Фізика твердого тіла: вступ до принципів матеріалознавства. Отримано з books.google.co.ve


