Структура, властивості, застосування, токсичність, чотирихлористий вуглець (CCl4)
The тетрахлорид вуглецю Це безбарвна рідина, з трохи солодким запахом, схожа на запах ефіру і хлороформу. Його хімічна формула - CCl4, і він являє собою ковалентне і летюче з'єднання, пар якого має більшу щільність, ніж повітря; Це не сприяє електроенергії, а також не є вогненебезпечним.
Воно зустрічається в атмосфері, воді річок, моря і відкладеннях морської поверхні. Вважається, що тетрахлорид вуглецю, присутній у червоних водоростях, синтезується одним і тим же організмом.
У атмосфері вона утворюється внаслідок реакції хлору і метану. Промислово вироблений тетрахлорид вуглецю надходить в океан, головним чином через морсько-повітряний інтерфейс. Підраховано, що його атмосферний потік => океанічний становить 1,4 × 1010 г / рік, що еквівалентно 30% від загального вмісту чотирихлористого вуглецю в атмосфері.
Індекс
- 1 Основні характеристики
- 2 Структура
- 3 Фізико-хімічні властивості
- 4 Використання
- 4.1 Хімічне виробництво
- 4.2 Виробництво холодоагентів
- 4.3 Придушення вогню
- 4.4 Чищення
- 4.5 Хімічний аналіз
- 4.6 Інфрачервона спектроскопія та ядерний магнітний резонанс
- 4.7 Розчинник
- 4.8 Інші види використання
- 5 Токсичність
- 5.1 Гепатотоксичні механізми
- 5.2 Токсичні ефекти на ниркову систему та центральну нервову систему
- 5.3 Вплив впливу на людину
- 5.4 Токсичні взаємодії
- 6 Міжмолекулярні взаємодії
- 7 Посилання
Основні характеристики
Тетрахлорид вуглецю виробляється промисловим шляхом термічним хлоруванням метану, при цьому метан реагує з газоподібним хлором при температурі від 400 ° С до 430 ° С. Під час реакції утворюється сирий продукт з побічним продуктом соляної кислоти.
Він також виробляється промисловим методом сірковуглецю. Хлор і сірковуглець вводять в реакцію при температурі від 90 ° C до 100 ° C, використовуючи залізо в якості каталізатора. Потім необроблений продукт піддають фракціонуванню, нейтралізації та дистиляції.
CCl4 мав багаторазове застосування, серед іншого: розчинник жирів, масел, лаків тощо; хімчистка одягу; пестицидів, у сільськогосподарському та фунгіцидному фумігації та нейлоновому виробництві. Однак, незважаючи на велику корисність, його використання частково виключено через високу токсичність.
У людини він породжує токсичну дію на шкіру, очі і дихальні шляхи. Але його найбільш шкідливі наслідки виникають у функціонуванні центральної нервової системи, печінки і нирок. Пошкодження нирок, можливо, є основною причиною смертності, пов'язаної з токсичною дією чотирихлористого вуглецю.
Структура
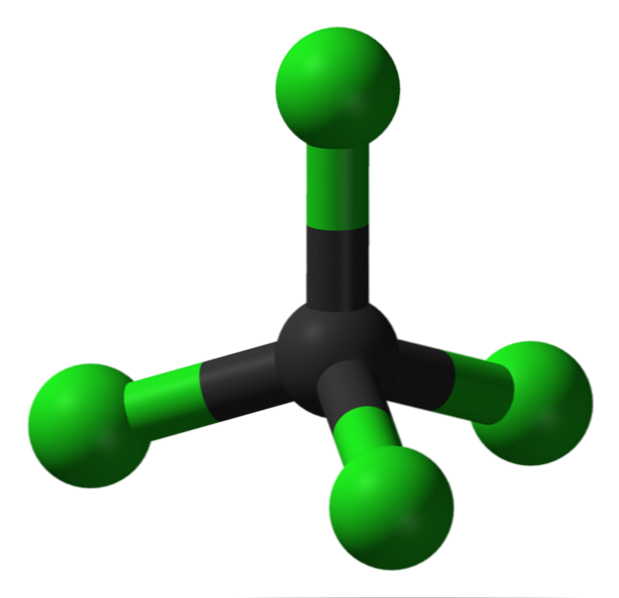
На зображенні видно структуру чотирихлористого вуглецю, яка є тетраедричною геометрією. Зауважимо, що атоми Cl (зелені сфери) орієнтуються в просторі навколо вуглецю (чорної сфери), малюючи тетраедр.
Також варто згадати, що оскільки всі вершини тетраедра однакові, структура є симетричною; тобто не має значення, як молекула CCl обертається4, Вона завжди буде такою ж. Потім, починаючи з зеленого тетраедра CCl4 симетричний, має наслідком відсутність постійного дипольного моменту.
Чому? Оскільки, хоча зв'язки C-Cl є полярними внаслідок більшої електронегативності Cl по відношенню до C, ці моменти скасовуються векторно. Таким чином, він є неполярним хлорированним органічним з'єднанням.
Вуглець повністю хлорується в CCl4, що дорівнює високому окислення (вуглець може утворювати максимум чотири зв'язки з хлором). Цей розчинник не прагне втрачати електрони, він апротичний (він не має водню), і він являє собою засіб транспортування і мале зберігання хлору..
Фізико-хімічні властивості
Формула
CCl4
Молекулярна маса
153,81 г / моль.
Зовнішній вигляд
Це безбарвна рідина. Він кристалізується у вигляді моноклінних кристалів.
Запах
Представлений характерний запах, присутній в інших хлорованих розчинниках. Запах ароматичний і трохи солодкий, схожий на запах тетрахлоретилену і хлороформу.
Точка кипіння
170,1 ºF (76,8 ºC) до 760 мм рт.
Точка плавлення
-9ºF (-23ºC).
Розчинність у воді
Він погано розчинний у воді: 1,16 мг / мл при 25ºC і 0,8 мг / мл при 20ºC. Чому? Оскільки вода, високополярна молекула, не "відчуває" спорідненість до чотирихлористого вуглецю, який не є аполярним.
Розчинність в органічних розчинниках
Через симетрію його молекулярної структури чотирихлористий вуглець є неполярним з'єднанням. Тому вона змішується зі спиртом, бензолом, хлороформом, ефіром, сірковуглецем, петролейним ефіром і нафтою. Крім того, він розчинний у етанолі та ацетоні.
Щільність
У рідкому стані: 1,59 г / мл при 68 ° F і 1,594 г / мл при 20 ° C.
У твердому стані: 1,831 г / мл при -186 ºC і 1,808 г / мл при -80 ºC.
Стабільність
Зазвичай інертний.
Корозійна дія
Атакує деякі форми пластмас, каучуків і покриттів.
Точка запалювання
Вона вважається не дуже легкозаймистою, що вказує на температуру запалювання менше 982 ºC.
Автоматичне запалювання
982 ° C (1800 ° F; 1255 K).
Щільність пари
5.32 по відношенню до повітря, прийняте за опорне значення, рівне 1.
Тиск пари
91 мм рт.ст. при 68 ° F; 113 мм рт.ст. при 77 ºF і 115 мм рт.ст. при 25 ºC.
Розкладання
У присутності вогню утворюється хлорид і фосген, сильно токсичні сполуки. Крім того, за тих же умов він розкладається на хлористий водень і монооксид вуглецю. У присутності води при високих температурах вона може викликати соляну кислоту.
В'язкість
2,03 х 10-3 Па · с
Поріг запаху
21,4 ppm.
Показник заломлення (ηD)
1,4607.
Використання
Хімічне виробництво
-Він діє як хлоруючий агент та / або розчинник у виробництві органічного хлору. Крім того, він втручається як мономер у виробництві нейлону.
-Діє як розчинник у виробництві гумового цементу, мила та інсектициду.
-Його використовують у виробництві хлорфторуглеродного палива.
-Не маючи C-H-зв'язків, чотирихлористий вуглець не зазнає вільнорадикальних реакцій, тому він є корисним розчинником для галогенирования або елементарним галогеном, або галогенирующим реагентом, таким як N-бромсукцинимид..
Виробництво холодоагентів
Його використовували у виробництві хлорфторуглерода, холодоагенту Р-11 і трихлорфторметана, хладагента Р-12. Ці холодоагенти руйнують озоновий шар, тому вони рекомендували припинити їх використання відповідно до рекомендацій Монреальського протоколу..
Придушення вогню
На початку 20-го століття чотирихлористий вуглець почав використовуватися як вогнегасник, заснований на наборі властивостей сполуки: він є летючим; його пар важче повітря; Він не є електричним провідником і він не є легкозаймистим.
При нагріванні тетрахлорид вуглецю перетворюється на важкий пар, який охоплює продукти згоряння, виділяючи їх від присутнього в повітрі кисню і викликаючи випалення вогню. Він підходить для боротьби з нафтовими пожежами та приладами.
Однак, при температурі вище 500 ° C, чотирихлористий вуглець може вступати в реакцію з водою, викликаючи фосген, токсичне з'єднання, тому увагу необхідно приділяти вентиляції під час використання. Крім того, він може вибухово реагувати з металевим натрієм, уникаючи його використання у вогнищах з наявністю цього металу.
Прибирання
Тетрахлорид вуглецю використовувався при сухому чищенні одягу та інших матеріалів для використання в домашніх умовах. Крім того, він використовується як промисловий обезжириватель металів, відмінний для розчинення жиру і масла.
Хімічний аналіз
Використовується для виявлення бору, броміду, хлориду, молібдену, вольфраму, ванадію, фосфору та срібла.
Інфрачервона спектроскопія та ядерний магнітний резонанс
-Він використовується як розчинник в інфрачервоній спектроскопії, оскільки тетрахлорид вуглецю не має значного поглинання в смугах> 1600 см-1.
-Він використовувався як розчинник в ядерному магнітному резонансі, оскільки він не заважав техніці, оскільки не мав водню (він апротичний). Але через його токсичності, і тому, що його потужність розчинника низька, чотирихлористий вуглець був замінений дейтерованими розчинниками..
Розчинник
Характерною особливістю бути неполярним з'єднанням є використання чотирихлористого вуглецю в якості розчинника для масел, жирів, лаків, лаків, гумових воску та смол. Він також може розчиняти йод.
Інші види використання
-Це важливий компонент лавових ламп, оскільки завдяки своїй щільності чотирихлористий вуглець додає вагу воску.
-Використовується колекторами штемпелів, оскільки воно виявляє водяні знаки на марках, не завдаючи шкоди.
-Його використовували як пестицид, фунгіцид і в розпиленні зерна з метою усунення комах.
-У процесі різання металу використовується як мастило.
-Вона застосовувалася у ветеринарії як антигельмінтик у лікуванні фасциолаза, викликаного Fasciola hepatica у овець.
Токсичність
-Тетрахлорид вуглецю може всмоктуватися через дихальні, травні, очні та шкірні шляхи. Прийом всередину та інгаляції є дуже небезпечними, оскільки вони можуть викликати тривалий серйозний ушкодження мозку, печінки та нирок.
-Контакт з шкірою викликає роздратування і в довгостроковій перспективі може викликати дерматит. При контакті з очима викликає роздратування.
Гепатотоксичні механізми
Основними механізмами, що викликають ураження печінки, є окислювальний стрес і зміна гомеостазу кальцію..
Окислювальний стрес - це дисбаланс між виробництвом активних форм кисню і здатністю організму генерувати відновлююче середовище, в межах своїх клітин, що контролює окислювальні процеси.
Дисбаланс у нормальному окисно-відновному стані може викликати токсичні ефекти при виробництві пероксидів і вільних радикалів, які пошкоджують всі компоненти клітин.
Тетрахлорид вуглецю метаболізується з утворенням вільних радикалів: Cl3C. (радикал трихлорметил) і Cl3COO. (радикал трихлорметилпероксид). Ці вільні радикали виробляють липопероксидацию, що викликає пошкодження печінки, а також легенів.
Вільні радикали також викликають розрив плазматичної мембрани клітин печінки. Це призводить до збільшення цитозольної концентрації кальцію і зниження внутрішньоклітинного механізму секвестрації кальцію.
Внутрішньоклітинний приріст кальцію активує фермент фосфоліпаза А2 що діє на фосфоліпіди мембрани, посилюючи її афектацію. Крім того, спостерігається інфільтрація нейтрофілів і гепатоцелюлярна травма. Відбувається зниження клітинної концентрації АТФ і глутатіону, що викликає ферментативну інактивацію і загибель клітин.
Токсичні ефекти в нирковій системі та центральній нервовій системі
Токсичні ефекти чотирихлористого вуглецю проявляються в нирковій системі при зниженні утворення сечі і накопичення води в організмі. Особливо в легенях і збільшення концентрації метаболічних відходів у крові. Це може призвести до смерті.
На рівні центральної нервової системи відбувається залучення аксонального проведення нервових імпульсів.
Ефекти впливу людини
Коротка тривалість
Подразнення очей; Вплив на печінку, нирки і центральну нервову систему, може призвести до втрати свідомості.
Тривала тривалість
Дерматит і можлива канцерогенна дія.
Токсичні взаємодії
Існує зв'язок між багатьма випадками інтоксикації чотирихлористим вуглецем і вживанням алкоголю. Надмірне споживання алкоголю викликає пошкодження печінки, у деяких випадках викликає цироз печінки.
Було відмічено, що токсичність чотирихлористого вуглецю зростає з барбітуратами, оскільки вони мають подібні токсичні ефекти.
Наприклад, на рівні нирок, барбітурати знижують виведення сечі, ця дія барбітуратів схожа на токсичну дію чотирихлористого вуглецю на функцію нирок.
Міжмолекулярні взаємодії
CCl4 Його можна розглядати як зелений тетраедр. Як вона взаємодіє з іншими?
Будучи аполярною молекулою, без постійного дипольного моменту, вона не може взаємодіяти з диполь-дипольними силами. Щоб утримувати їх молекули разом в рідині, атоми хлору (вершини тетраедрів) повинні певним чином взаємодіяти один з одним; і вони досягають успіху завдяки дисперсійним силам Лондона.
Електронні хмари атомів Cl рухаються, і протягом коротких моментів генерують багаті та бідні області електронів; тобто вони генерують миттєві диполі.
Багата область електронів δ- викликає поляризацію атома Cl сусідньої молекули: Clδ-δ+Таким чином, два атоми Cl можуть утримуватися разом протягом обмеженого часу.
Але, маючи мільйони молекул CCl4, взаємодії стають достатньо ефективними для утворення рідини в нормальних умовах.
Крім того, чотири Cl, ковалентно зв'язані з кожним C, значно збільшують кількість цих взаємодій; настільки, що вона закипає при температурі 76,8ºC, високій точці кипіння.
Температура кипіння CCl4 вона не може бути вищою, оскільки тетраедри відносно малі порівняно з іншими аполярними сполуками (наприклад, ксилолом, який кипить при 144ºC).
Список літератури
- Хардінгер А. Стівен. (2017). Ілюстрований глосарій органічної хімії: тетрахлорид вуглецю. Отримано з: chem.ucla.edu
- Всі Сіявула. (s.f.). Міжмолекулярні та міжатомні сили. Отримано з: siyavula.com
- Кері Ф. А. (2006). Органічна хімія (Шосте видання). Mc Graw Hill.
- Вікіпедія. (2018). Тетрахлорид вуглецю. Отримано з: en.wikipedia.org
- PubChem. (2018). Тетрахлорид вуглецю. Отримано з: pubchem.ncbi.nlm.nih.gov
- Хімічна книга. (2017). Тетрахлорид вуглецю. Отримано з: chemicalbook.com


