Формула оксиду літію, властивості, ризики та застосування
The оксид літію являє собою неорганічну хімічну сполуку формули Li2Або що утворюється разом з невеликими кількостями перекису літію, коли метал літію спалюється в повітрі і поєднується з киснем.
До 1990-х років на ринку металу та літію домінували американські виробництва з родовищ корисних копалин, але на початку 21-го століття більша частина продукції була отримана з неамериканських джерел; Австралія, Чилі та Португалія були найважливішими постачальниками у світі. Болівія має половину відкладень літію в світі, але це не великий виробник.
Найбільш важливою комерційною формою є карбонат літію, Li2CO3, виробляються з мінералів або розсолів за допомогою декількох різних процесів.
Коли літій спалюється на повітрі, основним продуктом є білий оксид оксиду літію, Li2Крім того, утворюється пероксид літію, Li2O2, також білий.
Це також можна здійснювати шляхом термічного розкладання гідроксиду літію, LiOH або перекису літію, Li2O2
4Li (s) + O2(g) → 2Li2O (s)
2LiOH (s) + тепла → Li2O (s) + H2O (g)
2Li2O2(s) + тепло → 2Li2O (s) + O2(g)
Фізико-хімічні властивості
Оксид літію - це біла тверда речовина, відома як літія, яка не має аромату і солоного смаку. Його вигляд показаний на малюнку 2 (Національний центр інформації про біотехнології, 2017).

Фігура 2: зовнішній вигляд оксиду літію
Оксид літію - це кристали з геометрією антифлорит, подібною до геометрії натрію хлориду (кубічний центрирован на гранях). Його кристалічна структура представлена на малюнку 3 (Mark Winter [Університет Шеффілда і WebElements Ltd, 2016].
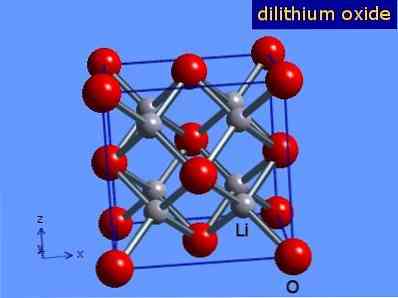
Фіг.3: кристалічна структура оксиду літію.
Його молекулярна маса становить 29,88 г / моль, її щільність - 2,013 г / мл, а температури плавлення і кипіння - 1438 ° С і 2066 ° С відповідно. З'єднання дуже добре розчиняється у воді, спирті, ефірі, піридині і нітробензолі (Royal Society of Chemistry, 2015).
Оксид літію легко реагує з водяною парою з утворенням гідроксиду, а з діоксидом вуглецю утворює карбонат; тому його слід зберігати і обробляти в чистому й сухому середовищі.
Оксидні сполуки не призводять до електрики. Однак певні структуровані оксиди перовскіту є електронними провідниками, які знаходять застосування в катоді твердооксидних паливних елементів і систем генерації кисню.
Вони являють собою сполуки, які містять принаймні один аніон кисню і один металічний катіон (American Elements, S.F.).
Реактивність і небезпека
Оксид літію - стабільна сполука, несумісна з сильними кислотами, водою і діоксидом вуглецю. Наскільки нам відомо, хімічні, фізичні та токсикологічні властивості оксиду літію не досліджувалися і не повідомлялися в глибину.
Токсичність сполук літію є функцією їх розчинності у воді. Іон літію має токсичність центральної нервової системи. З'єднання має сильно корозійний подразник, якщо він контактує з очима, шкірою, при вдиханні або потраплянні в організм (ESPI METALS, 1993).
У разі контакту з очима слід перевірити, чи носите контактні лінзи, і негайно видаліть їх. Очі слід промити проточною водою протягом принаймні 15 хвилин, залишаючи відкриті повіки. Можна використовувати холодну воду. Мазь не повинна використовуватися для очей.
Якщо хімічна речовина контактує з одягом, видаліть її якомога швидше, захищаючи власні руки і тіло. Помістіть жертву під душем безпеки.
Якщо хімічна речовина накопичується на відкритій шкірі потерпілого, наприклад, на руках, обережно і ретельно мийте шкіру, забруднену проточною водою і неабразивним милом. Можна використовувати холодну воду. Якщо подразнення зберігається, зверніться за медичною допомогою. Перед повторним використанням промийте забруднений одяг.
У разі інгаляції потерпілому слід дозволити відпочивати в добре провітрюваному приміщенні. Якщо інгаляція є серйозною, жертву слід якомога швидше евакуювати до безпечної зони.
Ослабте щільний одяг, наприклад, комір сорочки, ремені або краватку. Якщо потерпілому важко дихати, слід вводити кисень. Якщо потерпілий не дихає, проводиться реанімація рот в рот.
Завжди беручи до уваги, що може бути небезпечно для особи, яка надає допомогу, для реанімації рот в рот, коли інгаляційний матеріал є токсичним, інфекційним або корозійним.
У всіх випадках слід негайно звернутися до лікаря (SIGMA-ALDRICH, 2010).
Використання
Оксид літію використовується в якості флюсу в керамічних глазурі і створює блакитний колір з міддю і трояндами з кобальтом. Оксид літію реагує з водою і парою, утворюючи гідроксид літію і повинен бути ізольований від них.
Оксид літію (Li2O) з високим потенціалом тритію є привабливим кандидатом для твердого культурального матеріалу електростанції злиття DT, завдяки високій щільності атомів літію (порівняно з іншими літієвими або металевими літієвими кераміками) і його провідністю відносно високі термічні (оксид літію (Li2O), SF).
Лі2Або він буде піддаватися впливу високих температур при опроміненні нейтронами під час експлуатації плавких ковдр. За цих обставин у Li відбудеться велика кількість дефектів опромінення2Або, наприклад, індуковане гелію набухання, відносно високе термічне розширення, зростання зерна, утворення LiOH (T) і осадження при низьких температурах і транспорт маси LiOH (T) при високих температурах.
Крім того, Li2Або він буде підданий напругам, що виникають внаслідок різниці в тепловому розширенні між Li2Про і конструкційні матеріали. Ці характеристики Li2Або вони призводять до складних інженерних проблем як у виробництві, так і в дизайні ковдри.
Можливе нове використання - це заміна кобальту та оксиду літію як катода в літій-іонних акумуляторах, що використовуються для живлення електронних пристроїв від мобільних телефонів до ноутбуків, а також автомобілів з батареєю (Reade International Corp, 2016).
Список літератури
- Марк Зима [Університет Шеффілда та ТОВ «WebElements» (2016). веб-елементи. Взяті з літію: окис ділітію webelements.com.
- Американські елементи. (S.F.). Оксид літію. Взяті з americanelements americanelements.com.
- ESPI METALS. (1993, червень). Оксид літію. Взяті з espimetals espimetals.com.
- Оксид літію (Li2O). (S.F.). Взяті з ferp.ucsd.edu ferp.ucsd.edu.
- Національний центр біотехнологічної інформації. (2017, 24 червня). База даних PubChem Compound; CID = 166630. Взяті з PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Порошок оксиду літію (Li2O). Взяті з reade reade.com
- Королівське хімічне товариство. (2015). Оксид літію.Взяті з chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Паспорт безпеки матеріалу Оксид літію. Взяті з chemblink chemblink.com.


