Оксид марганцю (MnO2) Хімічна структура, властивості та застосування
The оксид марганцю (MnO2) є неорганічним хімічним з'єднанням, утвореним елементом марганцю з кількістю окислення +4 і киснем, який при утворенні оксидів має число окислення -2. Він також відомий під назвою оксиду марганцю (IV) і марганцевого ангідриду.
Це тверда від темної до чорної кави. Вона є в природі мінералом пиролюзит, чорним і кристалізованим утворюють дендрити (розгалужені елонгації). Він може бути отриманий у вигляді чорного залишку в реакції між етиленом і перманганатом калію після утворення гліколю окислювальною дією перманганату калію \ t.

Це дуже важливо в скляній промисловості завдяки своєму характеру окислювача, оскільки усуває зелений колір, що надходить із сполук заліза, і перетворює їх у чорні.
Індекс
- 1 Хімічна структура
- 2 Властивості
- 3 Використання
- 3.1 Як каталізатор
- 4 Вплив на здоров'я
- 5 Посилання
Хімічна структура
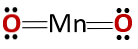
Хімічна структура сполуки відповідає структурі ангідриду, а не основному оксиду, як і слід було очікувати, оскільки він складається з металу і неметалу.
Цей особливий випадок пояснюється поведінкою марганцю в різних станах його окислення. Таким чином, для станів окислення +2 і +3 утворюються оксиди MnO і Mn2O3 відповідно, що при взаємодії з водою вони утворюють гідроксид марганцю і гідроксид марганцю відповідно.
Однак Mn2O3 у слабокислому середовищі він веде себе як ангідрид. З окислювальними станами +4, +6 і +7, MnO2, MnO3 і MnO4 вони утворюють кислоти при взаємодії з водою.
У слабокислому середовищі MnO2 він веде себе як основний оксид, тому він може утворювати відповідний гідроксид.

Слід мати на увазі, що в цьому випадку немає згадки про амфотерні властивості, згідно з яким з'єднання може вести себе як кислота або як основа. Це особливий випадок поведінки Mn.
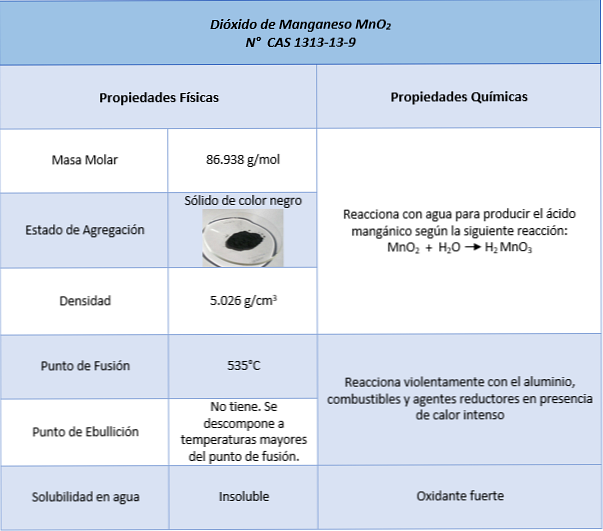
Властивості
Використання
- Використовується як джерело марганцю
- В якості окислювача в лужних батареях
- Фарби для скла, кераміки й порцеляни.
- При отриманні хлору і йоду.
- При розкладанні перекису водню для утворення газоподібного кисню і води.
- У реакції розкладання хлорату калію для виробництва газоподібного кисню і хлориду калію.
- Розчиняють в ацетоні або в дихлорметане, окисляють первинні спирти до альдегідів і вторинні до кетонів.
- Виробництво лужних батарей.
В якості каталізатора
Це стосується оксидно-відновних реакцій, для видалення сульфідів, таких як Н2S і катіони типу Fe+2 і Mn+2 , миш'як і радіостанції, виявлені в підземних водах, забруднені цим типом сполук.
Таке забруднення може бути спричинене або неконтрольованим скиданням токсичних матеріалів, миттям забрудненого ґрунту або наявністю хімічних елементів під час видобування води.
MnO2 Висока чистота, отримана з піролюзиту, використовуваного в якості фільтра (Filox), є найбільш ефективним засобом видалення цього класу домішок з підземних вод.
Вплив на здоров'я
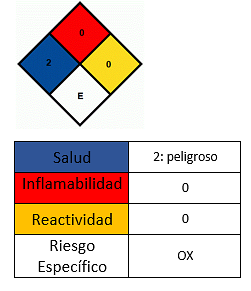
- Уникайте контакту зі шкірою.
- У разі контакту промийте відповідну ділянку.
- Не вдихайте порошки.
- Роздратування і почервоніння можна побачити при контакті з очима. Вимийте великою кількістю води, пропустіть воду через очі і зателефонуйте за медичною допомогою у випадку серйозного захворювання.
- При контакті з шкірою спостерігається подразнення і почервоніння. Вимийте уражену ділянку великою кількістю води і мила.
- Тривалий контакт зі шкірою видаляє ваш природний жир, викликаючи дерматит.
- Вдихання може призвести до грипоподібного стану (металеві пари). Стан характеризується високою температурою, ознобом, сухим ротом і горлом, м'язовими болями і головним болем.
- Він може дратувати дихальні шляхи і збільшити частоту респіраторних інфекцій (пневмонії). Інтоксикація поглинанням неорганічних солей марганцю через легені малоймовірна, але може відбутися хронічне отруєння.
- Хронічний вплив пилу або газів на діоксид марганцю протягом тривалого періоду може впливати на центральну нервову систему і призвести до розвитку хвороби Паркінсона, труднощів при ходьбі, м'язових спазмів і змін у поведінці.
- Прийом всередину може викликати біль у животі та нудоту.
- Вона не є вогненебезпечною, але допомагає поширювати вогонь в лампах розжарювання. При нагріванні до температури вище 535 ° С речовина розкладається на оксид марганцю (III) Mn2O3 і кисень, який є легкозаймистим і збільшує небезпеку пожежі. У цьому випадку вогонь слід гасити піною або вуглекислим газом.
- У разі розливу не маніпулюйте сумішшю без належного захисту.
- Зберігайте з'єднання в щільно закритих контейнерах, в холодному і сухому місці і подалі від несумісних речовин, таких як органічний матеріал і горючий матеріал.
- Місце зберігання повинно бути сухим і мати підлоги стійкі до кислотної корозії та з хорошим дренажем..
- Необхідно використовувати засоби індивідуального захисту, такі як рукавички, захисні окуляри, протигазові фільтруючі маски, пил і дим.
Список літератури
- B, (2015), діоксид марганцю, Королівське хімічне товариство - світ хімії, отриманий з
- Karal, (2014), двоокис мангнесо, паспорт безпеки, відновлений з, karal.com.mx
- Ваш віртуальний вчитель (2015-02-25). Марганцеві неорганічні сполуки (спеціальний випадок 1) - Теоретичний урок), витягнуті з, youtube.com
- Ecured, (s.f), діоксид марганцю, відновлений з ecured.cu
- Angarita G, Johnny., (2017), двоокис марганцю: надзвичайна технологія. Hydrotec, відновлений з hydrotecocr.com
- Fernández, G., (2015), діоксид марганцю MnO2/ ацетон, Органічна хімія, Відновлено з quimicaorganica.net
- Tronox, (2011), діоксид марганцю, паспорт безпеки, відновлений з, tronox.com


