Основа крові агару, використання та підготовка
The кров'яний агар це збагачена тверда середовище, диференційна, але не селективна. Використовується для відновлення і росту великої кількості мікроорганізмів з клінічних зразків або субкультур.
Класичний кров'яний агар повинен бути включений для посіву більшості клінічних зразків, отриманих в лабораторії; за винятком зразків калу, де він не є корисним, якщо не приготований з певними модифікаціями.
Ця культуральна середовище в основному складається з збагаченого базового агару і 5% крові. Основа агару може змінюватися в залежності від потреб, але в основному складається з пептонів, амінокислот, вітамінів, м'ясного екстракту, хлориду натрію, агару.
Що стосується крові, то зазвичай потрібно мати контакт з біотерієм для отримання крові у тварин, таких як вівці, кролики або коні. Однак це не завжди можливо, і іноді використовується людська кров.
Середовище кров'яного агару можна приготувати в лабораторії або можна придбати готовим для компаній, які присвячені цьому. Приготування цього середовища є одним з найбільш делікатних, будь-яка недбалість при його підготовці призведе до забрудненої партії.
Тому необхідно вжити всіх можливих заходів обережності, а в кінцевому підсумку контролювати якість інкубації при 37 ° C 1 пластини на кожні 100.
Індекс
- 1 Фонд
- 2 Використання
- 2.1 Вибір групи крові
- 2.2 Вибір базового типу агару
- 2.3 Використання кров'яного агару відповідно до основного середовища, що використовується для його приготування
- 3 Підготовка
- 3.1 Зважують і розчиняють
- 3.2 Стерилізація
- 3.3 Агрегація крові
- 3.4 Налийте в чашки Петрі
- 4 Посилання
Фонд
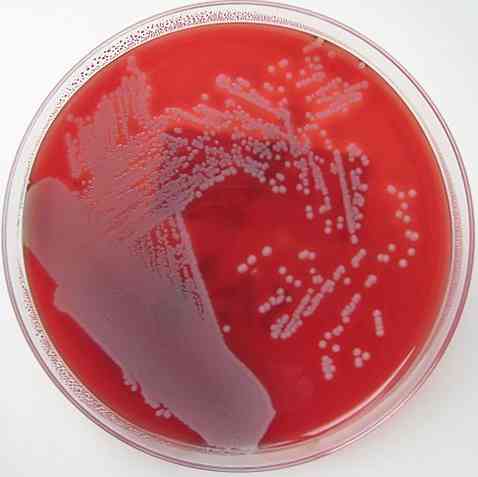 Вже було згадано, що кров'яний агар має властивість бути збагаченим, диференційним і неселективним середовищем. Підстава кожного з цих властивостей пояснюється нижче.
Вже було згадано, що кров'яний агар має властивість бути збагаченим, диференційним і неселективним середовищем. Підстава кожного з цих властивостей пояснюється нижче.
Кров'яний агар є збагаченим середовищем, оскільки він має в якості основної добавки 5 -10% крові на базі агару. Обидва сполуки містять багато поживних речовин, і ця властивість дозволяє більшість вирощуваних бактерій рости в ній.
Це зростання відбувається без обмежень; з цієї причини вона неселективна. Однак, якщо до цього середовища додаються сполуки, що перешкоджають росту деяких мікроорганізмів і сприяють росту інших, то вони стають селективними. Це відбувається, якщо додаються певні типи антибіотиків або протигрибкових засобів.
Аналогічно, кров'яний агар є диференційною середовищем, оскільки дозволяє виділити 3 типи бактерій: бета-гемолітичну, альфа-гемолітичну і гамма-гемолітичну..
Бета-гемолітики - це ті, що здатні лізувати або повністю порушувати червоні кров'яні клітини, утворюючи явний ореол навколо колоній, таким чином, гемоліз - гемоліз і мікроорганізми називаються ß-гемолітичними.
Прикладами β-гемолітичних бактерій є Streptococcus pyogenes і Streptococcus agalactiae.
Альфа-гемолітики - це ті, що виконують частковий гемоліз, де гемоглобін окислюється до метгемоглобіну, генеруючи зеленуватості навколо колоній. Це явище відоме як гемоліз α або α-гемоліз, і бактерії класифікуються як α-гемолітичні.
Прикладами є α-гемолітичні бактерії Streptococcus pneumoniae і Стрептокок групи viridans.
Нарешті, існують бактерії, що називаються гамма-гемолітичними або негемолітичними. Вони ростуть на агарі без утворення змін на ньому, ефект відомий як γ -гемоліз, а мікроорганізми γ-гемолітичні.
Приклад γ-гемолітичних бактерій: деякі штами Streptococcus групи D (\ tStreptococcus bovis і Enterococcus faecalis).
Використання
Культуральне середовище з кров'яним агаром є одним з найбільш часто використовуваних в лабораторії мікробіології.
Серед мікроорганізмів, здатних вирощувати на середовищі крові агар, є: суворі, факультативні, мікроаерофільні, анаеробні, грампозитивні або грамнегативні аеробні бактерії, швидкозростаючі або повільно зростаючі бактерії.
Також ростуть деякі бактерії, які з поживної точки зору вимогливі або неприємні, а також гриби та дріжджі. Також корисно субкультивувати або реактивувати штами, які є дуже слабкими метаболічно.
Однак, вибір групи крові і базового агару буде змінюватися в залежності від вірогідного мікроорганізму, який підозрюється у відновленні, і від використання, який повинен бути зроблений бляшкою (культура або антибіограма)..
Вибір групи крові
Кров може бути бараниною, кроликом, конем або людиною.
Найбільш рекомендованою є кров ягняти, за деякими винятками. Наприклад, для виділення виду Haemophilus, де рекомендована кров є конем або кроликом, оскільки кров ягняти має ферменти, які пригнічують фактор V.
Найменш рекомендованим є людський, проте він найчастіше використовується, можливо тому, що його найпростіше отримати.
Кров повинна бути дефібринована, отримана без будь-якого типу добавки і від здорових тварин. Для використання крові людини слід мати на увазі кілька факторів:
Якщо кров надходить від осіб, які перенесли бактеріальні інфекції, вони будуть мати специфічні антитіла. У цих умовах зростання деяких бактерій, ймовірно, буде гальмуватися.
Якщо вона отримана з банку крові, вона містить цитрат і можливо, що певні бактерії не розвиваються в її присутності. З іншого боку, якщо кров надходить від пацієнтів, які приймають антибіотики, зростання сприйнятливих бактерій може пригнічуватися.
І якщо кров від діабетичної особи, то надлишок глюкози перешкоджає правильному розвитку гемолізу.
Вибір базового типу агару
Базовий агар, який використовується для приготування кров'яного агару, може бути дуже широким. Серед них: поживний агар, інфузійний агар головного мозку, соєвий агар триптикази, агар Мюллера Хінтона, агар Тейер Мартін, амбар Колумбії, агар Brucella, агар Campylobacter і т.д..
Використання кров'яного агару відповідно до основного середовища, що використовується для його приготування
Поживний агар
Ця основа найменш використовується, тому що на ній будуть рости переважно невимогливі бактерії, такі як кишкові бацили, Pseudomonas sp, S. aureus, Bacillus sp, серед інших. Не рекомендується ізолювати Streptococcus.
Серцевий агар для інфузії серця (BHI)
Він є одним з найбільш використовуваних в якості основи кров'яного агару, оскільки має необхідні поживні речовини для росту більшості бактерій, у тому числі Streptococcus sp та інші вимогливі бактерії. Хоча не доцільно спостерігати закономірності гемолізу.
З цією базою зазвичай використовують кров з баранини.
Також можуть бути отримані варіанти кров'яного агару, де додаються інші сполуки для виділення певних мікроорганізмів. Наприклад, інфузійний агар головного мозку, доповнений кролячою кров'ю, цистином і глюкозою, служить для ізоляції Francisella tularensis.
Тоді як з цистином телурит корисний для ізоляції Corynebacterium diphteriae. Можна використовувати кров людини або ягняти.
З першим бета-гемоліз буде виглядати як вузький ореол, тоді як з другого гало буде набагато ширше.
Крім того, ця база разом з бацитрацином, кукурудзяним крохмалем, кінською кров'ю та іншими добавками для збагачення (IsoVitaleX) використовується для виділення роду Haemophilus sp з дихальних зразків.
Також, якщо додати комбінацію антибіотиків хлорамфеніколу - гентаміцину або пеніциліну - стрептоміцину з кінською кров'ю, вона ідеально підходить для виділення вимогливих патогенних грибів, навіть з більш високим врожаєм, ніж Сабуро глюкозного агару. Це особливо корисно в ізоляції Росії Histoplasma capsulatum.
Трипсивна соя
Ця база є найбільш рекомендованою для кращого спостереження за характером гемолізу та проведенням діагностичних тестів, таких як таксони оптоквину та бацитрацину. Це класичний кров'яний агар, який використовується регулярно.
За допомогою цієї підстави можна також приготувати спеціальний кров для агар Corynebacterium diphteriae, з цистином телуру і кров агнця.
Крім того, поєднання цього агару з кров'ю баранини і канаміцином-ванкоміцином ідеально підходить для росту анаеробів, особливо Bacteroides sp.
Агар Мюллер Хінтон
Ця основа, доповнена кров'ю, використовується для виконання антибіограмми вимогливих мікроорганізмів, таких як Streptococcus sp.
Це також корисно для ізоляції бактерій Legionella pneumophila.
Агар Тейер Мартін
Це середовище ідеально підходить як основа для кров'яного агару, коли підозрюється рід роду Neisseria Neisseria meningitidis, з N. gonorrhoeae не росте на кров'яному агарі.
Він також служить для виконання тестів сприйнятливості Neisseria meningitidis.
Агар Колумбія
Ця основа відмінно підходить для висівання зразків біопсій шлунка в пошуках Helicobacter pylori.
Середовище готують, додаючи 7% крові ягняти, дефібриновані антибіотиками (ванкоміцин, триметоприм, амфотерицин В і цефсулодин), щоб обмежити зростання інших типів бактерій, які можуть бути присутніми.
Таку ж базу, доповнену кров'ю людини або ягняти, налидіксовою кислотою і колистином, корисно для ізоляції Gardnerella vaginalis. Він також ідеально підходить для оцінки антимікробної сприйнятливості до антибіотиків того ж мікроорганізму.
Крім того, він використовується для приготування кров'яного агару для культивування анаеробів, додавання аміноглікозидів і ванкоміцину.
Ця основа дозволяє нам правильно спостерігати закономірності гемолізу.
Бруселла Агар
Це середовище, використовуване в якості основи кров'яного агару разом з додаванням вітаміну К, ідеально підходить для вирощування анаеробних бактерій. У цьому випадку рекомендується використання ягнячої крові.
Campylobacter agar
Агар Campylobacter з 5% овечої крові та 5 антибіотиками (цефалотин, амфотерицин В, триметоприм, поліміксин В і ванкоміцин) є середовищем, що використовується для ізоляції Campylobacter jejuni у зразках калу.
Підготовка
Кожен комерційний будинок виводить на задню частину упаковки інструкції для приготування літра культурального середовища. Відповідні розрахунки можуть бути зроблені для приготування необхідної кількості відповідно до обраного базового агару.
Зважують і розчиняють
Основний агар надходить зневоднений (порошок), тому його необхідно розчиняти в дистильованій воді, доведені до рН 7,3.
Кількість, зазначену вибраним базовим агаром, зважують і розчиняють у відповідному кількості води у фіолі, потім нагрівають до помірного тепла і змішують з обертовими рухами, поки весь порошок не розчиняється..
Стерилізувати
Після розчинення стерилізують в автоклаві при 121 ° С протягом 20 хвилин.
Сукупність крові
При виході з автоклава дозволяють фіолі охолонути, поки температура не коливається від 40 до 50 ° C; це температура, яку підтримує шкіра людини, і в той же час агар ще не застигла.
Для цього фіола торкається рукою, і якщо тепло є прийнятним, ідеальною є температура для додавання відповідної кількості дефібринованої крові (50 мл на літр агару). Обережно перемішати до гомогенізації.
Проходження сукупної крові має вирішальне значення, оскільки якщо воно робиться, коли середовище дуже гаряче, червоні клітини крові розірвуться, а середовище не буде служити для спостереження за гемолізом..
Якщо він буде доданий занадто холодно, утворюються грудочки і поверхня середовища не буде гладкою, щоб зробити флейту належним чином.
Налийте в чашки Петрі
Подавати в стерильних чашках Петрі одразу після гомогенізації крові. Приблизно 20 мл розливають у кожну чашку Петрі. Цю процедуру виконують в ламінарному потоці або поблизу пальника.
При подачі кров'яного агару в чашки Петрі, на поверхні пластинки не повинні залишатися бульбашки повітря. Якщо це відбудеться, полум'я пальника Бунзена швидко пройде над пластиною, щоб усунути їх..
Пластинам дають можливість застигнути і зберігати в холодильнику (2-8 ° С), перевертаючи до використання. Перед використанням кров'яні агарові пластинки повинні бути загартовані (дайте їм приймати кімнатну температуру) для висівання.
Приготовлені пластини тривають приблизно 1 тиждень.
Список літератури
- Байона М. Мікробіологічні умови культивування Helicobacter pylori. Rev Col Gastroenterol 2013 рік; 28 (2): 94-99
- García P, Paredes F, Fernández del Barrio M. (1994). Практична клінічна мікробіологія. Університет Кадісу, 2-е видання. Служба публікацій UCA.
- "Кров агару". Вікіпедія, Вільна енциклопедія. 10 грудня 2018, 14:55 UTC. 27 грудня 2018, 01: 49 en.wikipedia.org.
- Forbes B, Sahm D, Вайсфельд А. (2009). Мікробіологічна діагностика Bailey & Scott. 12 ed. Аргентина Panamericana S.A Редакція.
- Лабораторний ветеринарний діагностичний центр CEDIVET. Гватемала Доступно за адресою: trensa.com.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Мікробіологічна діагностика. (5-е изд.). Аргентина, редакція Panamericana S.A..


