Фундамент, методика і застосування фарбування спорами
The фарбування спор є методологія, що використовується для фарбування структур опору, які утворюють деякі бактеріальні пологи, коли вони знаходяться в несприятливих умовах; ці структури відповідають способу виживання.
Є багато пологів, які утворюють спори; однак основними є Bacillus і Clostridium. Ці пологи вважаються більш актуальними, оскільки вони мають патогенні види для людини.
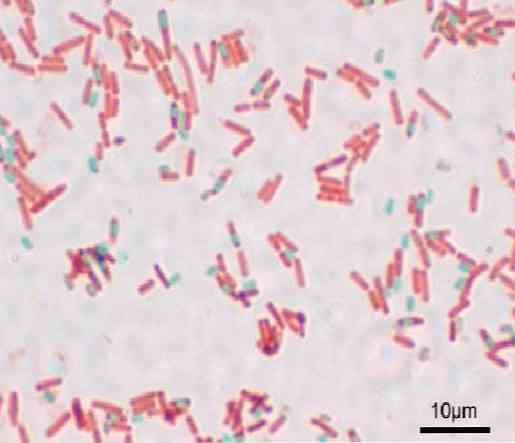
Кожна паличка може давати спору. Під час фарбування препарату спори можна знайти всередині бактерії (ендоспори) або поза неї (екзоспори). З традиційними методами фарбування для бактерій - таких як Gram пляма - спори залишаються безбарвними.
В даний час існує кілька методів розфарбовування, які здатні перетнути товсту структуру спори, щоб пофарбувати її. Ці методики дуже різноманітні; серед них можна згадати техніку Дорнера, пляму Мёллера і методологію Шеффера-Фултона, також відому як Wirtz-Conklin..
З усіх згаданих методів методологія Шеффера-Фултона найчастіше використовується у звичайних лабораторіях. Свою назву вона зобов'язана двом мікробіологам, які створили забарвлення в 1930 році: Алісія Шеффер і Макдональд Фултон. Однак іноді ця техніка називається Wirtz-Conklin на честь двох бактеріологів 1900-х років.
Індекс
- 1 Фонд
- 2 Споровий метод фарбування
- 2.1 Техніка Дорнера
- 2.2 Модифікована техніка Дорнера
- 2.3 Техніка Шеффера-Фултона або Віртц-Конкліна
- 2.4
- 2.5 Змінена техніка Мёлера без нагрівання
- 3 Використання
- 3.1 Приклади
- 4 Посилання
Фонд
Спори не забарвлюються звичайними забарвленнями, тому що вони мають дуже щільну стінку. Складний склад спор запобігає надходженню більшості барвників.
Якщо спори вивчаються ззовні всередину, то спостерігаються наступні шари: по-перше, екзопоріум, який є найтоншим зовнішнім шаром, утвореним глікопротеїнами..
Потім надходить кутикула, яка забезпечує стійкість до високих температур, за яким слідує кора, що складається з пептидоглікану. Потім є стіна підстави, яка захищає протопласт.
Спора - це зневоднена структура, яка містить 15% кальцію і дипиколиновую кислоту. Тому більшість спорових методів забарвлення засновані на застосуванні тепла, так що барвник може проникати в товсту структуру.
Після забарвлення спори вона не може усунути барвник. У техніці Шеффера-Фултона малахіт зеленого кольору надходить у вегетативні клітини, а після нагрівання проникає в ендоспору, а також в екзоспори.
При промиванні водою барвник видаляється з вегетативної клітини. Це відбувається тому, що зелений малахітовий барвник трохи основний, тому він слабко зв'язується з вегетативною клітиною.
З іншого боку, він не може вийти зі спори і, нарешті, протиставити паличку з сафранином. Цей фундамент справедливий для інших методів, в яких відбувається щось подібне.
Спори забарвлення
Щоб спори плями, ви повинні мати чисту культуру підозрілого штаму, який ви хочете вивчити.
Культуру піддають екстремальній температурі протягом 24 годин, щоб стимулювати мікроорганізм спорулювати. Для цього культуру можна помістити в сушильну шафу при температурі 44 ° C або в холодильнику (8 ° C) протягом 24 або 48 годин.
Якщо залишиться занадто багато часу при згаданих температурах, спостерігатимуться лише екзоспори, оскільки всі ендоспори залишать бацилу.
Після закінчення часу кілька крапель стерильного фізіологічного розчину слід помістити на чистий предметний предмет. Потім беруть невелику частину врожаю і роблять дрібний розкид.
Після цього вона залишається висихати, вона фіксується до тепла, і вона заплямована деякими з методів, які пояснюються нижче:
Техніка Дорнера
1- Готують в пробірці концентровану суспензію спорульованого мікроорганізму в дистильованій воді і додають рівний об'єм відфільтрованого фенольного фусину Kinyoun.
2. Помістіть пробірку у ванну з киплячою водою протягом 5-10 хвилин.
3 - На чистому слайсі змішати краплю попередньої суспензії з краплею 10% водного розчину нігрозину, кип'ятити і відфільтрувати..
4- Розширюйте і швидко висушуйте з м'яким теплом.
5- Вивчення з об'єктивом 100X (занурення).
Спори червоні, а бактеріальні клітини виглядають майже безбарвними на темно-сірому тлі.
Модифікована техніка Dorner
1- Суспензія спорульованого мікроорганізму розповсюджується на слайді і фіксується до тепла.
2- Зразок покривають смужкою фільтрувального паперу, до якої додають фуніцин фениновой кислоти. Барвник нагрівають протягом 5 - 7 хвилин з полум'ям пальника Бунзена до утворення випарів. Потім папір видаляється.
3- Промийте препарат водою, а потім просушіть абсорбуючим папером.
4- Накрийте мазок тонким плівкою 10% нігрозину, використовуючи другий слайд для поширення нігрозину або голки.
Забарвлення, що приймається спор і бактерій, є таким же, як описано в попередньому рівні техніки.
Техніка Шеффера-Фултона або техніки Віртца-Конкліна
1- Зробити тонкий спред суспензією спорульованого мікроорганізму на слайді і зафіксувати його на теплі.
2- Накрийте слайд водним розчином 5% малахітового зеленого (на аркуші можна розмістити фільтрувальний папір).
3 - Нагрійте на полум'я пальника Бунзена, щоб вивести пар і видалити полум'я. Повторіть операцію протягом від 6 до 10 хвилин. Якщо під час процедури занадто сильно випаровується малахітовий зелений розчин, можна додати більше.
4- Зніміть фільтрувальний папір (якщо він був поміщений) і промийте водою.
5- Накрийте слайд 0,5% водним сафранином протягом 30 секунд (деякі варіанти техніки використовують 0,1% водний сафранін і залишають на 3 хвилини)..
При цій техніці спори зелені, а бацили - червоні.
Це має той недолік, що ендоспори молодих культур не добре забарвлюються, оскільки вони виглядають надзвичайно прозорими або безбарвними. Щоб уникнути цього, рекомендується використовувати культури 48 годин інкубації.
Техніка Мёллера
1- Покрийте мазок хлороформом протягом 2 хвилин.
2- Відкиньте хлороформ.
3- Накрити 5% хромовою кислотою протягом 5 хвилин.
4- Промийте дистильованою водою
5- Лист покритий фуксин-феноловим коропом і піддається впливу полум'я пальника Бунзена до виділення парів; потім витягують з полум'я на кілька хвилин. Операцію повторюють до досягнення 10 хвилин.
6- Промийте водою.
7- Використовують підкислений етанол (хлористоводневий спирт) для знебарвлення. Залишається на 20 або 30 секунд.
8- Промити дистильованою водою.
9- Протидійте покриттю листа метиленовим синім протягом 5 хвилин.
10 - промивають дистильованою водою.
11- Він залишається висихати і зразок береться під мікроскопом.
Спори виглядають червоними і синіми бацилами. Важливо не вдихати пари, тому що вони токсичні, і в довгостроковій перспективі вони можуть бути канцерогенними.
Модифікована техніка Мёлера без нагрівання
У 2007 році Hayama та його співробітники створили модифікацію техніки Möeller. Вони видалили етап нагрівання барвника і замінили його додаванням 2 крапель поверхнево-активної речовини Tergitol 7 на кожні 10 мл фуксин-фенольного карболового розчину. Одержані ті ж результати.
Використання
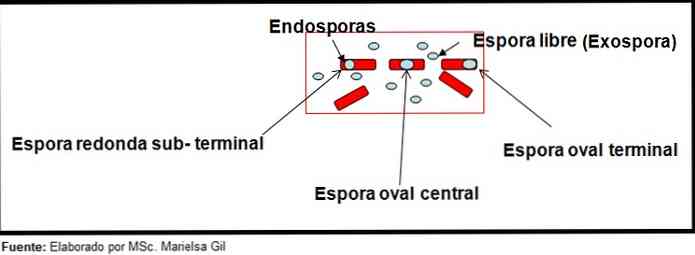
Розфарбування спор надає дуже цінну і корисну інформацію для ідентифікації патогена, оскільки наявність такої, її форми, розташування в межах палички і здатність деформувати рослинну клітину чи ні, є даними, які можуть направляти види залучені до певної статі.
У цьому контексті варто згадати, що спори можуть бути круглими або овальними, вони можуть бути розташовані в центрі або також в парацентральному, субтерминальном або кінцевому положенні..
Приклади
- Clostridium difficile утворює овальну спору в кінцевому положенні, що деформує паличку.
- Спори Клостридій tertium Воно овальне, не деформує паличку і знаходиться на кінцевому рівні.
- Ендоспора Росії Клостридій тетані це кінцева і деформує бацилу, даючи зовнішній вигляд гомілки.
- Спори Росії Clostridium botulinum, C. histolyticum, C. novy і C. septicum вони є круглими або субтерминальними овальними і деформують бацилу.
- Ендоспора Росії Clostridium sordelli воно розташоване в центральному положенні, з невеликою деформацією.

Список літератури
- Хаяма М., Оана К., Козакай Т., Умеда С., Фуджімото J, Ота Х, Кавакамі Ю. Пропозиція спрощеного методу фарбування бактеріальних спор без застосування тепло-успішної модифікації методу Моеллера. Eur J Med Res. 16 12 (8): 356-9.
- Учасники Вікіпедії. Пляма Moeller. Вікіпедія, вільна енциклопедія. 3 листопада, 2018, 03:28 UTC. Доступно за адресою: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Лабораторний посібник з мікробіологічних методів. Кафедра основних наук АМН. Національний політехнічний інститут.
- "Ендоспора". Вікіпедія, Вільна енциклопедія. 25 лютого 2018 р., 10:20 UTC. 10 січ. 2019, 02:42: en.wikipedia.org
- Сільва Л., Сільва С, Фернандес Н., Буено С., Торрес Дж, Ріко М, Макіаш J і співавтори. (2006). Трудовий колектив Автономного співтовариства Естремадура. Конкретна програма Том IV. Редакція MAD. Севілья-Іспанія, стор 211-212.
- Сільва М., Гарсія М, Корралес Я., Понсе Е. (2006), спеціаліст-лаборант Галицької служби охорони здоров'я (SERGAS). Предмет конкретного тома 2. Редакція MAD. Севілья-Іспанія, с. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Мікробіологічна діагностика. (5-е изд.). Аргентина, редакція Panamericana S.A..
- Forbes B, Sahm D, Вайсфельд А. 2009. Мікробіологічна діагностика Bailey & Scott. 12 ed. Аргентина Panamericana S.A Редакція


