Фундамент, матеріали, техніка та застосування Гимза
The Гимза пляма являє собою тип фарбування клінічних зразків, заснований на суміші кислотних і основних барвників. Його створення було натхнене роботою Романовського, де Густав Гімса, хімік і бактеріолог з Німеччини, удосконалив його, додавши гліцерин для стабілізації сполук..
Зміни, спричинені оригінальною методикою Романовського, дозволили значно поліпшити мікроскопічні спостереження, тому техніка хрестилася з назвою плями Giemsa.
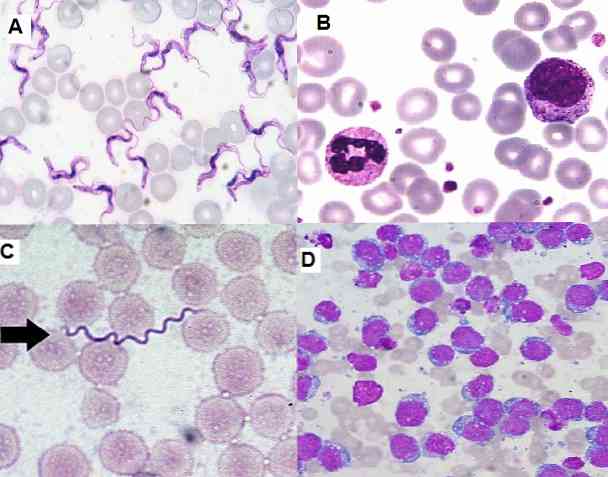
Оскільки вона є простою технікою для виконання, високо функціональною і економічною, вона в даний час широко використовується в клінічній лабораторії для гематологічних мазків, зразків кісткового мозку і зрізів тканин..
Метод фарбування Гімзи дуже корисний для цитологічних досліджень, оскільки дозволяє спостерігати за специфічними структурами клітин. Ця методика забарвлює цитоплазми, ядра, ядра, вакуолі та гранули клітин, здатні розрізняти навіть дрібні сліди хроматину..
Крім того, можуть бути виявлені значні зміни в розмірі, формі або забарвленні ядра, де можна візуалізувати втрату зв'язків ядро-цитоплазму..
З іншого боку, це дозволяє виявити незрілі клітини в кістковому мозку і периферичній крові, будучи важливими для діагностики серйозних захворювань, таких як лейкемія. Також можна виявляти гемопаразити, екстра та внутрішньоклітинні бактерії, гриби, серед інших.
У цитогенетиці він цілком використовується, оскільки можна вивчити мітоз клітин.
Індекс
- 1 Основа забарвлення Гімзи
- 2 Матеріали
- 2.1 Матеріали для приготування маточного розчину
- 2.2 Режим приготування маточного розчину
- 2.3 Матеріали для приготування буферного розчину
- 2.4 Підсумкова підготовка барвника
- 2.5 Додаткові матеріали, необхідні для виконання фарбування
- 3 Техніка
- 3.1 Процес фарбування
- 4 Утиліти
- 4.1 Гематологія
- 4.2 Мікологія
- 4.3. Бактеріологія
- 4.4 Паразитологія
- 4.5 Цитологія
- 4.6 Цитогенетика
- 5 Дослідження, що демонструють ефективність фарбування Giemsa
- 6 Рекомендації для хорошого фарбування
- 7 Поширені помилки в забарвленні Giemsa
- 7.1 Надзвичайно синя забарвлення
- 7.2 Надмірно рожеве забарвлення
- 7.3 Наявність опадів у мазку
- 7.4 Наявність морфологічних артефактів
- 8 Режим зберігання
- 9 Посилання
Основа забарвлення Гімзи
Барвники типу Романовського засновані на використанні контрасту між кислотними і основними барвниками, щоб досягти фарбування основних і кислотних структур відповідно. Як видно, існує спорідненість кислотних барвників до фарбування основних структур і навпаки.
Основним використовуваним барвником є метиленовий синій і його окислені похідні (Azure A і Azure B), а кислотний барвник - еозин.
Кислотні структури клітин являють собою нуклеїнові кислоти, гранули сегментованих базофілів, серед інших, тому вони будуть пофарбовані метиленовим синім..
У цьому ж сенсі основними структурами клітин є гемоглобін і деякі гранули, такі як ті, що містяться в сегментованих еозинофілах, серед інших; вони будуть пофарбовані еозином.
З іншого боку, завдяки тому, що метиленовий синій і блакитний характеризуються метахроматичними барвниками, вони можуть забезпечувати змінний тон різних структур відповідно до навантаженням поліаніонів, якими вони володіють..
Таким чином, стратегічна комбінація основних і кислотних барвників здатна розробити широкий спектр кольорів, відповідно до біохімічних характеристик кожної структури, проходячи через блідо-блакитні, сині, бузкові і пурпурні тони у випадку кислих структур.
Хоча забарвлення, що надається еозином, є більш стійким, генеруючи кольори між червоно-оранжевим і лососевим.
Матеріали
Матеріали для приготування маточного розчину
Для приготування основного розчину потрібно вагою 600 мг порошкоподібного барвника Giemsa, вимірювання 500 см 3 метилового спирту без ацетону та 50 см 3 нейтрального гліцерину..
Режим приготування маточного розчину
Помістіть важкий порошок Giemsa в ступку. Якщо є грудочки, їх слід розпорошити. Згодом додають помітну кількість виміряного гліцерину і перемішують дуже добре. Отриману суміш виливають у дуже чисту бурштинову пляшку.
Решту гліцерину поміщають в ступку. Змішати знову, щоб очистити залишився барвник, який був приклеєний до стінок розчину, і вилити в ту ж пляшку.
Пляшку покривають і витримують протягом 2 годин на водяній бані при 55ºC. Перебуваючи у ванні з мармуру, злегка перемішайте суміш кожні півгодини.
Потім суміші дають охолонути, щоб помістити спирт. Раніше частина виміряного спирту поміщали в ступку, щоб закінчити миття, що залишилося від барвника, а потім його додають до суміші разом з рештою спирту.
Цей препарат слід дозрівати протягом принаймні 2 тижнів. Частина, яка використовується маточного розчину, повинна бути відфільтрована.
Щоб уникнути забруднення препарату, рекомендується пропускати частину, що постійно використовується, до невеликої бурштинової пляшки з крапельницею. Перезаряджайте кожен раз, коли реагент закінчується.
Матеріали для приготування буферного розчину
З іншого боку, буферний розчин при рН 7,2 готують наступним чином: \ t
Зважують 6,77 г фосфату натрію (безводного) (NaHPO4), 2,59 г дигідрофосфату калію (KH)2PO4) і дистильованої води до 1000 см3.
Остаточна підготовка барвника
Для приготування остаточного розчину для фарбування вимірюють 2 см відфільтрованого вихідного розчину і змішують з 6 см буферного розчину. Суміш перемішують.
Важливим фактом, який необхідно враховувати, є те, що методики приготування барвника можуть змінюватися відповідно до комерційного будинку.
Додаткові матеріали, необхідні для виконання фарбування
Крім описаних матеріалів, вона повинна бути забезпечена кольоровими мостами, екранами для води або буфером для миття, листами для предметів або кришок, секундоміром для контролю за часом забарвлення і промокаючим папером або матеріалом, який можна використовувати для сушіння ( марля або бавовна).
Техніка
Процес фарбування
1) Перед фарбуванням, ви повинні мати зразок поширюється на чистому слайді..
Зразками можуть бути кров, кістковий мозок, розрізи гістологічних тканин або цервіко-вагінальні зразки. Рекомендується, щоб сторонні речовини були тонкими і мали 1 або 2 години висихання перед фарбуванням.
2) Всі листи, які ви повинні пофарбувати, розміщені на кольоровому мості. Завжди працюйте в тому ж порядку і добре ідентифікуйте кожен лист.
3) Нанести на мазок кілька крапель 100% -ного метилового спирту (метанолу) і залишити на 3 - 5 хвилин, щоб зафіксувати і зневоднити зразок.
4) Викиньте метанол, присутній в аркуші, і дайте йому висушити повітря.
5) Після висихання помістіть кінцевий розчин з крапельницею до повного покриття. Залиште на 15 хвилин. Деякі автори рекомендують до 25 хв. Залежить від комерційного будинку.
6) Злийте барвник і промийте мазок дистильованою водою або 7,2 буферним розчином.
7) На промокальному папері дайте просушити аркуші на відкритому повітрі, розташовані вертикально за допомогою опори.
8) Протріть задню частину слайда марлевим або ватним тампоном, змоченим спиртом, щоб видалити залишився барвник.
Комунальні послуги
Техніка фарбування Giemsa використовується в декількох областях, включаючи: гематологію, мікологію, бактеріологію, паразитологію, цитологію та цитогенетику.
Гематологія
Це найчастіша утиліта, яка приділяється цьому фарбуванню. З його допомогою ми можемо ідентифікувати кожну клітину, що присутня в зразках кісткового мозку або периферичної крові. Також можна оцінити кількість кожної серії, виявити лейкоцитоз або лейкопенію, тромбоцитопенію та ін..
Оскільки вона чутлива до виявлення незрілих клітин, вона є актуальною в діагностиці гострих або хронічних лейкозів. Також можна діагностувати анемію, таку як серповидно-клітинна хвороба, серповидно-клітинна хвороба, серед інших..
Мікологія
У цій області звичайно використовується для пошуку Histoplasma capsulatum (внутрішньоклітинний диморфний гриб) у зразках тканин.
Бактеріологія
У гематологічних мазках, забарвлених Giemsa, можна виявити Borrelias sp у пацієнтів, у яких захворювання називається рецидивом лихоманки. Спірохети рясні серед еритроцитів, у зразках, взятих на фебрильному піку.
Також можна візуалізувати внутрішньоклітинні бактерії як Rickettsias sp і Chlamydia trachomatis в інфікованих клітинах.
Паразитологія
В області паразитології фарбування Giemsa дозволило поставити діагноз паразитарних захворювань, таких як малярія, хвороба Шагаса і лейшманіоз..
У двох перших паразити Plasmodium sp і Trypanosoma cruzi відповідно вони можуть бути візуалізовані в периферичній крові інфікованих пацієнтів, їх можна виявити на різних стадіях відповідно до фази, в якій захворювання.
Для поліпшення пошуку паразитів крові рекомендується використовувати пляму Giemsa, змішану з барвником May-Grünwald.
Крім того, шкірний лейшманіоз може бути діагностований при оцінці зразків біоптатів шкіри, забарвлених Giemsa, де виявлено паразита..
Цитологія
Фарбування Giemsa також використовується для цитологічного дослідження зразків ендоцервікалів, хоча це не є найчастіше використовуваною методикою для цієї мети..
Але у випадках дефіциту ресурсів можна використовувати, маючи функціональність, подібну до тієї, що пропонується технікою Папаніколау і за меншою ціною. Однак, це вимагає експертизи з боку експерта.
Цитогенетика
Важливою особливістю фарбування Giemsa є його здатність сильно зв'язуватися з регіонами, багатими ДНК-аденінами і тиминами. Це дозволяє візуалізувати ДНК під час мітозу клітин у різних станах конденсації.
Ці дослідження необхідні для виявлення хроматичних аберацій, таких як дуплікації, делеції або транслокації різних областей хромосом..
Дослідження, що демонструють ефективність фарбування Giemsa
Cannova et al (2016) порівнювали 3 методики фарбування для діагностики шкірного лейшманіозу.
Для цього вони використовували зразки, отримані від експериментальної тварини (Mesocrisetus auratus) Експериментально засіяно Leishmanias.
Автори показали, що фарбування Giemsa краще, ніж фарбування Pap-mart® та Gaffney. Тому вони вважали, що пляма Giemsa ідеально підходить для діагностики шкірного лейшманіозу.
Відмінні результати, отримані авторами, обумовлені тим, що комбінація барвників, що входять до складу суміші Giemsa, представляє необхідні умови для створення сприятливого контрасту, що дозволяє чітко розрізняти амастигові структури як внутрішньо, так і позаклітинно..
Інші методи (Pap-mart® і Gaffney) також зробили це, але слабкіше і тому важче уявити. Саме тому пляма Гімза рекомендована для паразитологічної діагностики лейшманіозу.
Аналогічним чином, дослідження, проведене Ramírez et al (1994), оцінювало достовірність плям Giemsa та Lendrum в кон'юнктивальних мазках для ідентифікації Chlamydia trachomatis.
Автори визначили, що фарбування Giemsa і Ledrum мають однакову специфічність, але Giemsa була більш чутливою.
Це пояснює, чому в даний час фарбування Giemsa є найбільш часто використовуваним для діагностики хламідійних інфекцій, особливо якщо є мало ресурсів.
Рекомендації для хорошого фарбування
Сушіння листів не слід прискорювати. Необхідно дочекатися пруденційного часу його висушування на відкритому повітрі. Приблизно 2 години.
Для кращого результату кольори відразу після 2 годин.
Для кращого закріплення і фарбування мазків зразок повинен бути розподілений на аркуші таким чином, щоб залишився тонкий і рівномірний шар..
Кращим зразком крові є капіляр, оскільки мазок проводиться безпосередньо з краплі крові і тому зразок не має добавки, що сприяє підтримці клітинних структур..
Однак, якщо використовується венозна кров, ЕДТА слід використовувати як антикоагулянт, а не як гепарин, оскільки останній зазвичай деформує клітини..
Поширені помилки в забарвленні Giemsa
У практиці цього забарвлення можна зробити помилки. Про це свідчать раптові зміни у відтінках споруд.
Надзвичайно синя забарвлення
Це може бути пов'язано з:
- Дуже густі мазки
- Перевищення часу фарбування
- Занадто маленьке миття.
- Використання реагентів значно вище нейтрального рН (лужних).
У цих умовах кольори наступних структур спотворюються, так що еритроцити замість вмираючих рожево-лососевих виглядатимуть зеленими, гранули еозинофілів, які повинні бути пофарбовані червоною цеглою, стануть синіми або сірими і так далі відхилення у звичайних тональностях.
Надмірно рожеве забарвлення
Це може бути пов'язано з:
- Недостатній час фарбування.
- Тривале або надмірне прання.
- Погана сушка.
- Використання дуже кислотних реагентів.
У цьому конкретному випадку структури, які зазвичай фарбуються синім кольором, не будуть майже видимими, в той час як структури, забарвлені в рожевий колір, матимуть дуже перебільшені тональності.
Приклад: еритроцити будуть мати яскраво-червоний або сильний оранжевий колір, ядерний хроматин буде виглядати блідо-рожевим, а гранули еозинофілів стануть яскраво-червоними..
Наявність опадів у мазку
Причинами можуть бути:
- Використовуйте брудні або погано промиті листи.
- Не дозволяйте мазку добре висихати.
- Залишити фіксуючий розчин занадто довго.
- Недостатня промивка в кінці фарбування.
- Неадекватна фільтрація або нефільтрація використовуваного барвника.
Наявність морфологічних артефактів
У мазках можуть з'явитися морфологічні артефакти, що ускладнює візуалізацію та інтерпретацію наявних структур. Це пов'язано з:
- Тип використовуваного антикоагулянта, наприклад гепарин.
- Використання брудних, пошкоджених або жирних аркушів.
Режим зберігання
Після підготовки барвник повинен зберігатися при кімнатній температурі (15 - 25 ° C), щоб запобігти випаленню барвника. Її слід зберігати в закритому янтарному контейнері.
Список літератури
- Cannova D, Brito E і Simons M. Оцінка методів забарвлення для діагностики шкірного лейшманіозу. Salus. 2016; 20 (2): 24-29.
- Реагенти PanReac Applichem ITW. Гимза пляма. Версія 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Іспанія.
- Clark G. Процедури фарбування (1981), 4т. Williams & Willkins.
- Прикладна клінічна хімія Барвник Giemsa для діагностики in vitro. Дистриб'ютор: cromakit.es
- Ramírez I, Mejía M, Гарсія де ла Riva J, Гермес F і Grazioso C. Діяльність Giemsa і Lendrum плями в кон'юнктивальних мазків для ідентифікації Chlamydia trachomatis. Бол Саніт Панам. 1994; 116 (3): 212-216.
- Касас-Рінкон Г. Загальна мікологія. 1994. 2-е місце, Центральний університет Венесуели, видання бібліотеки. Венесуела, Каракас.
- "Пляма Гімса". Вікіпедія, Вільна енциклопедія. 1 вер 2017, 01:02 UTC. 6 грудня 2018, en.wikipedia.org.


