Фонд Ziehl-Neelsen Stain, реагенти та техніка
The Пляма Ziehl-Neelsen в способі забарвлення для ідентифікації спирто-кислотостійких мікроорганізмів (ААР). Назва цієї мікробіологічної процедури відноситься до її авторів: бактеріолога Франца Зіля і патологоанатома Фрідріха Нілсена..
Цей метод є типом диференціального забарвлення, що передбачає використання різних барвників для створення контрасту між структурами, які потрібно спостерігати, диференціювати і пізніше ідентифікувати. Пляма Ziehl-Neelsen використовується для ідентифікації певних типів мікроорганізмів.
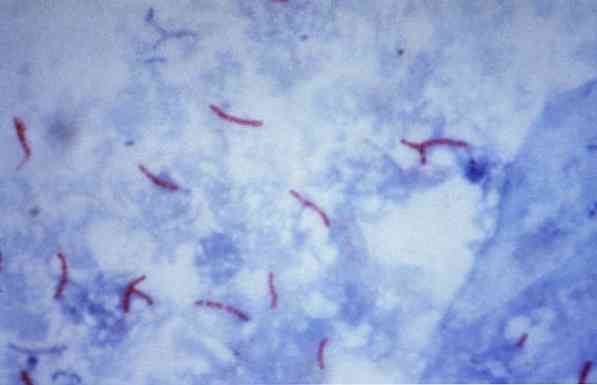
Деякі з цих мікроорганізмів є мікобактеріями (наприклад, Мікобактерії туберкульозу), нокардії (наприклад, Нокардія sp.) і деякі одноклітинні паразити (наприклад, Cryptosporidium parvum). Багато бактерій можна класифікувати за допомогою загальної методики, яка називається плямою Грам.
Однак деякі бактеріальні групи потребують інших методів їх ідентифікації. Такі методики, як фарбування Ziehl-Neelsen, вимагають комбінації барвників з теплом, щоб зафіксувати першу до клітинної стінки.
Потім відбувається процес знебарвлення, що дозволяє отримати два результати: стійкість або чутливість до знебарвлення кислотами і спиртами.
Індекс
- 1 Фонд
- 1.1 Вторинне фарбування
- 2 Реагенти
- 2.1 Первинне фарбування
- 2.2 Розчин для знебарвлення
- 2.3 Вторинне фарбування (анти-барвник)
- 3 Техніка
- 3.1 Процедура фарбування на швидку кислоту
- 4 Посилання
Фонд
В основі цієї технології фарбування лежать властивості клітинних стінок цих мікроорганізмів. Стінка утворена типом жирних кислот, званих міколовими кислотами; Вони характеризуються дуже довгими ланцюгами.
Коли жирні кислоти мають дуже довгі структури, вони можуть легко утримувати барвники. Деякі роди бактерій дуже важко забарвлюватись за допомогою забарвлення за Грамом, через високий вміст міколінової кислоти в клітинній стінці..
У плямі Ziehl-Neelsen використовується фенольна сполука carbol fuchsin, основний барвник. Це володіє здатністю взаємодіяти з жирними кислотами клітинної стінки, яка є воскоподібною текстурою при кімнатній температурі.
Фарсин Карболь покращується в присутності тепла, оскільки воск плавиться і молекули барвника рухаються швидше в клітинні стінки.
Кислота, яка використовується пізніше, служить для знебарвлення клітин, які не були забарвлені, оскільки їх стіна недостатньо пов'язана з барвником; отже, міцність кислого обесцвечителя здатна видаляти кислотний барвник. Клітини, які протистоять такому знебарвленню, називаються кислотостійкими.
Вторинне фарбування
Після знебарвлення зразка це контрастує з іншим барвником, який називається вторинним барвником. Як правило, використовується метиленовий синій або малахітовий зелений.
Вторинний барвник забарвлює фоновий матеріал і, отже, створює протилежність структурам, які були пофарбовані на першому етапі. Тільки знебарвлені клітини поглинають другий барвник (анти-плями) і приймають їх колір, а кислотостійкі клітини зберігають червоний колір.
Ця процедура часто використовується для ідентифікації Мікобактерії туберкульозу і Mycobacterium leprae, які називаються кислотостійкими бацилами.
Реагенти
Первинне фарбування
Використовують карбоксин 0,3% фуксину (фільтрують). Цей барвник готують із суміші спиртів: фенолу в етанолі (90%) або метанолу (95%), і в цій суміші розчиняють 3 г основного фуксину..
Розріджує розчин
На цьому етапі можна використовувати розчини 3% -ної спиртової кислоти або 25% -ної сірчаної кислоти.
Вторинне фарбування (анти-барвник)
Барвник, який зазвичай використовується для виконання контрасту в зразках, зазвичай становить 0,3% метиленового синього. Однак можуть бути також використані інші, такі як 0,5% -ний малахіт-зелений.
Техніка
Процедура фарбування швидкими кислотами
Готують бактеріальний мазок
Цей препарат виготовляють на чистому і сухому слайді, дотримуючись запобіжних стерильності.
Сушка мазка
Дайте мазку висохнути при кімнатній температурі.
Нагрівають зразок
Зразок повинен бути нагрітий шляхом подачі вогню на слайд нижче. Фіксація спиртом може бути зроблена, коли мазок не приготований з мокротою (оброблений гіпохлоритом натрію, щоб його відбілити), і якщо він не буде негайно забарвлений..
M. tuberculosis Усувається за допомогою відбілювача і під час процесу фарбування. Термофіксація нелікованої мокроти не знищить M. tuberculosis, тоді як фіксація спиртом є бактерицидною.
Накрийте пляму
Пляма покрита розчином фуміцину карболу (первинне основне забарвлення).
Нагрійте пляму
Це робиться протягом 5 хвилин. Ви повинні помітити випуск пари (приблизно 60 ° C). Важливо не перегріватися і не спалювати зразок.
Що стосується нагрівання плями, велика обережність повинна бути зроблена при нагріванні фуксинового карболу, особливо якщо фарбування проводиться на піддоні або іншому контейнері, в якому зі попереднього плями були зібрані легкозаймисті хімікати..
Під слайдами слід наносити лише невелике полум'я за допомогою освітленого тампона, попередньо змоченого кількома краплями кислого спирту, метанолу або 70% етанолу. Уникайте використання великого тампону, змоченого в етанолі, тому що це небезпека пожежі.
Вимийте пляму
Таке миття слід робити чистою водою. Якщо водопровідна вода не чиста, промийте мазок фільтрованою або дистильованою водою, бажано.
Накрийте мазок кислотним спиртом
Цей кислотний спирт повинен бути на рівні 3%. Покриття проводять протягом 5 хвилин або до тих пір, поки мазок не буде достатньо знебарвленим, тобто блідо-рожевим.
Слід враховувати, що кислотний спирт є вогненебезпечним; тому його слід використовувати дуже ретельно. Уникайте перебування поблизу джерел займання.
Вимийте пляму
Миття повинно проводитися з чистою, дистильованою водою.
Накрийте мазок фарбою
Це може бути зелений малахіт (0,5%) або метиленовий синій (0,3%) барвник протягом 1 або 2 хвилин, використовуючи найдовший час, якщо мазок тонкий.
Вимийте пляму
Чиста вода повинна бути знову використана (дистильована).
Каналізація
Задню частину слайда слід очистити, а пляма - на дренажній полиці, щоб вона сушилася на повітрі (не використовуйте абсорбуючу папір для сушіння).
Вивчіть мазок у мікроскопі
Необхідно використовувати об'єктив 100Х і масло для занурення. Систематично скануйте мазок і запишіть відповідні спостереження.
Інтерпретувати результати
Теоретично, мікроорганізми, пофарбовані в червонуватий колір, вважаються кислотостійкими позитивними (ААР +).
Навпаки, якщо мікроорганізми фарбуються синім або зеленим кольором, в залежності від барвника, що використовується в якості контра-барвника, вони вважаються негативною спиртостійкою кислотою (ААР-).
Список літератури
- Apurba, S. & Sandhya, B. (2016). Основи практичної мікробіології (1-е изд.). Медичні видавці Jaypee Brothers.
- Bauman, R. (2014). Мікробіологія з хворобами організмом (4-е видання). Pearson Education, Inc..
- Heritage, J., Evans, E. & Killington, A. (1996). Вступна мікробіологія (1-е изд.). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Навчальний посібник з лабораторії та збірник з мікробіології: застосування до лікування пацієнтів (11-е изд.). Освіта McGraw-Hill.
- Vasanthakumari, R. (2007). Підручник з мікробіології (1-е изд.). B.I. Публікації PVT.


