Структура, властивості, синтез і застосування циклогексену
The циклогексен являє собою алкен або циклічний олефін, молекулярна формула якого є C6H10. Він складається з безбарвної рідини, нерозчинної у воді і змішується з багатьма органічними розчинниками. Характеризується вогненебезпечністю, а в природі зазвичай знаходиться в кам'яновугільній смолі..
Циклогексен синтезують шляхом часткового гідрування бензолу і дегідратацією спиртового циклогексанолу; тобто, більш іржава форма. Як і інші циклоалкени, він піддається реакції електрофільного додавання і вільних радикалів; наприклад, реакцію галогенирования.
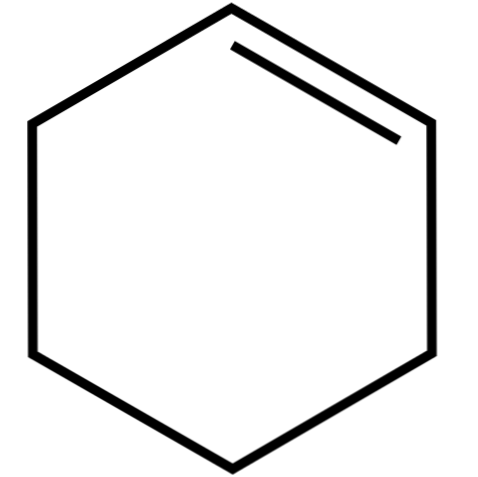
Цей циклічний алкен (верхнє зображення) утворює азеотропні суміші (не відокремлені перегонкою) з нижчими спиртами і оцтовою кислотою. Він не дуже стійкий при тривалому зберіганні, оскільки розкладається під дією сонячного світла і ультрафіолетового випромінювання.
Циклогексен використовується в якості розчинника, і тому має численні застосування, такі як: стабілізатор високооктанових бензинів і для екстракції масел.
Але найголовніше, що циклогексен служить проміжним і сировинним матеріалом для виробництва багатьох корисних сполук, серед яких: циклогексанон, адипінова кислота, малеїнова кислота, циклогексан, бутадієн, циклогексилкарбонова кислота тощо..
Індекс
- 1 Структура циклогексена
- 1.1 Міжмолекулярні взаємодії
- 2 Властивості
- 2.1 Хімічні назви
- 2.2 Молекулярна маса
- 2.3 Фізичний вигляд
- 2.4 Запах
- 2.5 Точка кипіння
- 2.6 Температура плавлення
- 2.7 Точка спалаху
- 2.8 Розчинність у воді
- 2.9 Розчинність в органічних розчинниках
- 2.10 Щільність
- 2.11 Щільність пари
- 2.12 Тиск пари
- 2.13 Автоматичне запалювання
- 2.14 Декомпозиція
- 2.15 В'язкість
- 2.16 Теплота згоряння
- 2.17 Випаровування тепла
- 2.18 Поверхневий натяг
- 2.19 Полімеризація
- 2.20 Поріг запаху
- 2.21 Індекс заломлення
- 2,22 рН
- 2.23 Стабільність
- 2.24 Реакції
- 3 Підсумок
- 4 Використання
- 5 Ризики
- 6 Посилання
Структура циклогексена
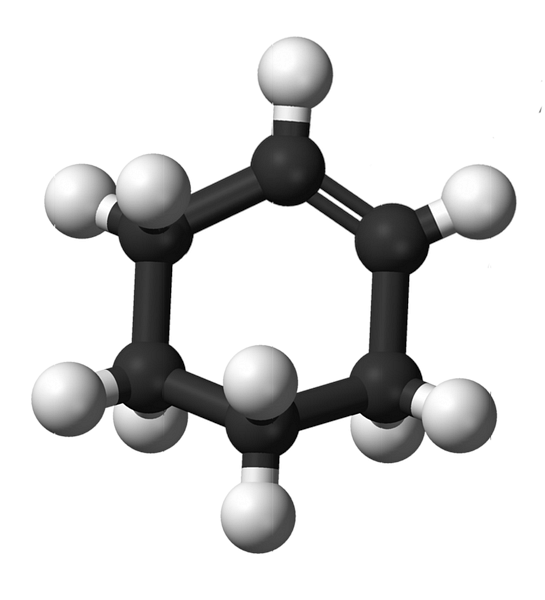
Структура циклогексена з моделлю сфер і брусів показана на зображенні вище. Можна помітити шість вуглецевого кільця і подвійний зв'язок, обидві ненасиченості сполуки. З цієї точки зору, здається, що кільце рівне; але це зовсім не є.
Для початку, вуглеки подвійного зв'язку мають sp гібридизацію2, що дає їм тригональну геометричну площину. Таким чином, ці два вуглецю, і ті, що примикають до них, знаходяться в одній площині; при цьому два вуглецю на протилежному кінці (до подвійного зв'язку) знаходяться вище і нижче зазначеної площини.
Нижнє зображення чудово ілюструє те, що тільки що було пояснено.

Зауважимо, що чорна смуга складається з чотирьох вуглецевих одиниць: двох подвійних зв'язків і інших, що прилягають до них. Виставлена перспектива є такою, яка була б отримана, якщо глядач розмістив своє око прямо перед подвійним зв'язком. Видно, що вуглець знаходиться вище і нижче цієї площини.
Оскільки молекула циклогексену не є статичною, два вуглецю обміняються: один буде знижуватися, а інший підніметься над площиною. Отже, ви очікуєте, що ця молекула поведеться.
Міжмолекулярні взаємодії
Циклогексен є вуглеводнем, і тому його міжмолекулярні взаємодії засновані на дисперсійних силах Лондона..
Це пояснюється тим, що молекула є неполярною, без постійного дипольного моменту, і її молекулярна маса є фактором, що найбільше сприяє збереженню його когезії в рідині..
Крім того, подвійний зв'язок підвищує ступінь взаємодії, оскільки він не може рухатися з тією ж гнучкістю, що й інші вугілля, і це сприяє взаємодії між сусідніми молекулами. Саме з цієї причини циклогексен має трохи більш високу температуру кипіння (83 ° C), ніж циклогексан (81 ° C)..
Властивості
Хімічні назви
Циклогексен, тетрагідробензол.
Молекулярна маса
82,146 г / моль.
Зовнішній вигляд
Безбарвна рідина.
Запах
Солодкий запах.
Точка кипіння
83 ºC до 760 мм рт.
Точка плавлення
-103,5 ºC.
Точка запалювання
-7ºC (закрита чашка).
Розчинність у воді
Практично нерозчинні (213 мг / л).
Розчинність в органічних розчинниках
Змішується з етанолом, бензолом, тетрахлоридом вуглецю, петролейним ефіром і ацетоном. Очікується, що він зможе розчиняти аполярні сполуки, як і деякі аллотропи вугілля.
Щільність
0,810 г / см3 при 20ºC.
Щільність пари
2,8 (відносно повітря, що приймається рівним 1).
Тиск пари
89 мм рт.ст. при 25ºC.
Автоматичне запалювання
244 ºC.
Розкладання
Розкладається в присутності солей урану, під дією сонячного світла і ультрафіолетового випромінювання.
В'язкість
0,625 мПаскаль при 25 ºC.
Теплота згоряння
3,751.7 кДж / моль при 25ºC.
Випаровування тепла
30,46 кДж / моль при 25 ° С.
Поверхневий натяг
26,26 мН / м.
Полімеризація
Він може полімеризуватися за певних умов.
Поріг запаху
0,6 мг / м3.
Індекс заломлення
1.4465 при 20 ºC.
рН
7-8 при 20ºC.
Стабільність
Циклогексен не дуже стійкий при тривалому зберіганні. Вплив світла і повітря може викликати виробництво пероксидів. Крім того, він не сумісний з сильними окислювачами.
Реакції
-Циклоалкени в основному мають реакції приєднання, як електрофільні, так і вільні радикали.
-Реагує з бромом з утворенням 1,2-дибромциклогексану.
-Окислюється швидко в присутності перманганату калію (KMnO4).
-Він здатний виробляти епоксид (оксид циклогексену) в присутності пероксибензойної кислоти.
Синтез
Циклогексен отримують шляхом кислотного каталізу циклогексанолу:
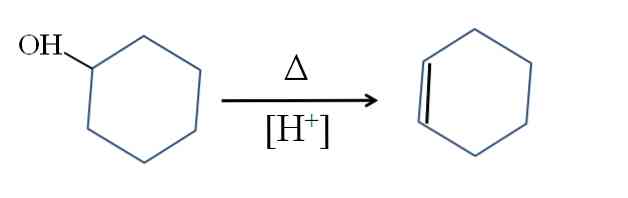
Символ Δ являє собою теплоту, необхідну для сприяння виходу групи ОН у вигляді молекули води в кислому середовищі (-ОН2+).
Циклогексен також отримують шляхом часткового гідрування бензолу; тобто дві його подвійні зв'язки додають молекулу водню:
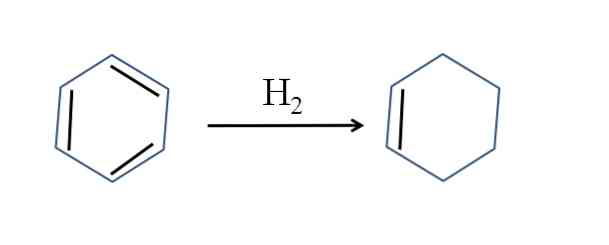
Хоча реакція здається простою, вона вимагає великих тисків H2 і каталізатори.
Використання
-Вона є корисною як органічний розчинник. Крім того, вона є сировиною для виробництва адипінової кислоти, адипінового альдегіду, малеїнової кислоти, циклогексану і циклогексилкарбонової кислоти..
-Його використовують у виробництві хлориду циклогексану, з'єднання, що використовується в якості посередника у виробництві фармацевтичних продуктів і добавок каучуку..
-Циклогексен також використовується в синтезі циклогексанону, сировини для виробництва лікарських засобів, пестицидів, парфумерії та барвників.
-Циклогексен бере участь у синтезі аминоциклогексанола, з'єднання, яке використовується в якості поверхнево-активної речовини і емульгатора..
-Крім того, циклогексен можна використовувати для приготування в лабораторії бутадієну. Останнє з'єднання використовується при виготовленні синтетичного каучуку, при виготовленні шин для автомобілів, а також використовується при виготовленні акрилових пластиків.
-Циклогексен є сировиною для синтезу лізину, фенолу, поліциклоолефінових смол і добавок каучуку.
-Використовується як стабілізатор високооктанових бензинів.
-Беруть участь у синтезі водонепроникних покриттів, стійких до тріщин плівок і зв'язуючих зв'язуючих для покриттів.
Ризики
Циклогексен не є дуже токсичним з'єднанням, але може викликати почервоніння шкіри і очей при контакті. Його вдихання може викликати кашель і сонливість. Крім того, його прийом може викликати сонливість, утруднене дихання і нудоту.
Циклогексен погано всмоктується в шлунково-кишковому тракті, тому серйозних системних ефектів не очікується внаслідок прийому всередину. Найбільшим ускладненням є його аспірація дихальною системою, яка може виробляти хімічну пневмонію.
Список літератури
- Джозеф Ф. Чіанг і Симон Харві Бауер. (1968). Молекулярна структура циклогексена. J. Am Chem. 1969, 91, 8, 1898-1901.
- Каррі Барнс. (2019). Циклогексен: небезпека, синтез і структура. Дослідження. Отримано з: study.com
- Morrison, R.T. and Boyd, R.N. (1987). Органічна хімія (5та .). Редакція Аддісон-Веслі Ібероамерикана.
- PubChem. (2019). Циклогексен. Отримано з: pubchem.ncbi.nlm.nih.gov
- Хімічна книга. (2019). Циклогексен. Отримано з: chemicalbook.com
- Токсикологічна мережа передачі даних. (2017). Циклогексен. Toxnet Отримано з: toxnet.nlm.nih.gov
- Хіміка. (s.f.). Структурна формула для циклогексена. Отримано з: chemoxy.com


