Формула гідроксиду кальцію, властивості, реактивність і застосування
The гідроксид кальцію, також відомий як гідратований вапно або гашене вапно, являє собою неорганічне з'єднання формули Ca (OH) \ t2.
Гідроксид кальцію використовує полімерну структуру, як і всі гідроксиди металів, ідентичні гідроксиду магнію (Mg (OH))2) також відомий як brucita.
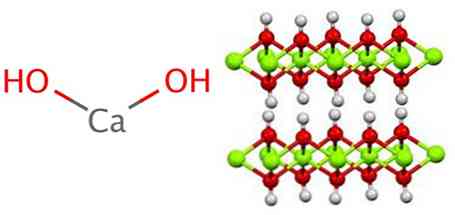
Видно, що в цій структурі відбувається утворення водневих мостів. Гідроксид кальцію синтезується промисловим шляхом реакцією оксиду кальцію, також відомого як вапно або негашене вапно, з водою згідно з наступною реакцією:
CaOH + H2O → Ca (OH)2
Його також готують в лабораторії шляхом реакції між водним хлоридом кальцію і гідроксидом натрію.
Гідроксид кальцію зустрічається природно, але рідко в мінеральній формі, як портландіт, який зустрічається в деяких вулканічних і метаморфічних породах. (Формула гідроксиду кальцію - використання, властивості, структура і формула гідроксиду кальцію, 2005-2017).
Ця сполука також широко доступна в цементних, розчинних і промислових очисниках (наприклад, будівельних виробах), шліфувальниках для підлоги, засобах для очищення цегли, продуктів згущення цементу та багатьох інших..
Водний розчин зазвичай називають вапняною водою. Вапняну воду готують перемішуванням гідроксиду кальцію в чистій воді і фільтруючи надлишок Ca (OH).2 не розчиняється.
При додаванні надлишкової гідроксиду кальцію до вапняної води отримують суспензію частинок гідроксиду кальцію, що надає їй молочний вигляд, і в цьому випадку вона має загальну назву вапняного молока. Вапняне молоко або насичений розчин вапна (вапняна вода) має рН 12,3, що має базову природу.
Фізико-хімічні властивості гідроксиду кальцію
Гідроксид кальцію являє собою білий або безбарвний порошок, позбавлений запаху. У водному розчині (насичених розчинах) він має молочний вигляд завдяки супернатанту нерозчиненого гідроксиду кальцію.
Ненасичені розчини зазвичай є прозорими і безбарвними розчинами, з легким земляним запахом і гірким лужним смаком гідроксиду кальцію. Зовнішній вигляд сполуки проілюстровано на Фіг.3 (Королівське хімічне товариство, 2015).

Гідроксид кальцію має молекулярну масу 74,093 г / моль і щільність 2,211 г / см3 у твердому стані. Він має температуру плавлення 580 градусів за Цельсієм. Він погано розчинний у воді, здатний розчиняти 1,89 г на літр при 0 ° C, 1,73 г на літр при 20 ° C і 0,66 г на літр при 100 ° C.
Розчинний у гліцерині та в кислотних розчинах. Нерозчинний у спирті (Національний центр біотехнологічної інформації, С.Ф.).
Гідроксид кальцію частково розчиняється у воді для одержання розчину під назвою «вапно», яке є помірною базою. Вапняна вода або Ca (OH)2 (aq) Він реагує з кислотами, утворюючи солі і може атакувати деякі метали, такі як алюміній. Вапняна вода легко реагує з діоксидом вуглецю, утворюючи карбонат кальцію, корисний процес, що називається карбонізацією:
Ca (OH)2 + CO2 → CaCO3 + H2O
Нітропарафіни, нітрометан, нітропропан тощо утворюють солі з неорганічними основами, такими як гідроксид кальцію. Ці сухі солі є вибухонебезпечними. З'єднання хімічно схоже з гідроксидом натрію (NaOH) або оксидом натрію (Na2O). Вони нейтралізують кислоти екзотермічно, утворюючи солі плюс воду.
Змішування цих матеріалів з водою може призвести до небезпечної кількості тепла, оскільки підстава розчиняється або розріджується. Основи реагують з певними металами (такими як алюміній і цинк), утворюючи оксиди металів або гідроксиди і генеруючи водень.
Основи можуть ініціювати реакції полімеризації в полімеризуються органічних сполуках, особливо епоксиди. Легкозаймисті та / або токсичні гази можуть утворюватися з солями амонію, нітридами, галогенированними органіками, різними металами, пероксидами та гідропероксидами. Цей тип сполуки часто служить каталізатором (Chemical Datasheet CALCIUM HYDROXIDE, S.F.).
Реактивність і небезпека

Гідроксид кальцію є стабільною сполукою, хоча і несумісний з сильними кислотами. Це класифікується як подразнююча речовина і серед його небезпек ми можемо виділити:
Він є корозійним для очей (вони викликають пошкодження рогівки або сліпоту) і шкіру (вони виробляють запалення і пухирі).
Вдихання пилу буде викликати подразнення в шлунково-кишковому або дихальному тракті, що характеризується печінням, чханням і кашлем. Важке перенасичення може викликати пошкодження легенів, асфіксію, втрату свідомості або смерть. Запалення очей характеризується почервонінням, подразненням і свербінням (паспорт безпеки матеріалу гідроксид кальцію, 2013).
Повторне вплив на очі при низькому рівні пилу може викликати подразнення і місцеве руйнування шкіри або дерматит на шкірі. Повторне вдихання пилу може призвести до різного ступеня подразнення дихання або пошкодження легенів.
Якщо цей хімікат контактує з очима, їх слід негайно промити великою кількістю води, іноді піднімаючи нижню і верхню повіки. Необхідно отримати негайну медичну допомогу. Контактні лінзи не повинні використовуватися при роботі з цією хімічною речовиною.
Якщо цей хімікат контактує з шкірою, шкіру, забруднену милом і водою, слід негайно промити. Якщо це речовина проникає в одяг, негайно видаліть одяг і промийте шкіру водою. Якщо подразнення зберігається після миття, зверніться до лікаря.
У разі вдихання великої кількості цього хімічного речовини негайно слід вивести особу на свіже повітря. Якщо дихання припинилося, виконуйте реанімацію з рота в рот, а також тримайте жертву в теплі і в стані спокою. Зверніться за медичною допомогою якомога швидше.
У разі проковтування негайно зверніться за медичною допомогою і, якщо можливо, покажіть контейнер або етикетку (отруєння гідроксидом кальцію, 2017).
Обробка та зберігання
- З'єднання слід зберігати в сухому контейнері.
- Не вмикайте і не вдихайте пил.
- Воду ніколи не слід додавати до цього продукту.
- У разі недостатньої вентиляції принесіть адекватне дихальне обладнання.
- Уникайте контакту зі шкірою та очима.
- Тримайте подалі від несумісних кислот.
- Зберігайте контейнер щільно закритим.
- Зберігайте контейнер у прохолодному і добре провітрюваному місці. Не зберігайте при температурі вище 25 градусів Цельсія.
Використання та застосування

Гідроксид кальцію виробляється у великих масштабах, легко обробляється, і, як правило, дешевий, тому існує безліч помітних застосувань і застосувань.
Значне застосування гідроксиду кальцію є подібним до флокулянта у очищенні води та стічних вод. Він утворює пухнасте заряджене тверде тіло, яке допомагає у видаленні менших частинок з води, в результаті чого утворюється більш легкий продукт.
Це застосування забезпечується низькою вартістю і низькою токсичністю гідроксиду кальцію. Він також використовується при обробці прісної води для підвищення рН води. Мета полягає в тому, що труби не роз'їдаються, коли основна вода є кислою.
Інше велике застосування полягає в паперовій промисловості, де він використовується у виробництві гідроксиду натрію. Це перетворення є компонентом відомого крафт-процесу, який використовується при екстракції целюлози.
У системах життєзабезпечення, таких як скрубер з вуглекислим газом, зокрема в респіраторах з замкнутим контуром, де гідроксид літію, будучи більш їдким, вважається занадто ризикованим.
Використовується як інгредієнт при відбілюванні та штукатурці, так званих вапняних розчинів. У дорожньому будівництві гідроксид кальцію служить для поліпшення якості ґрунту.
Згідно з даними Національних інститутів охорони здоров'я, гідроксид кальцію зазвичай застосовується в стоматологічній роботі як антимікробний засіб, і є речовиною вибору для формування захисного шару, відомого як апікальний бар'єр..
Апікальні бар'єри зазвичай використовуються як засіб для уникнення некрозу пульпи в ситуаціях, коли ендодонтична операція буде особливо складною, що зазвичай є результатом незрілого постійного зуба.
Оскільки гідроксид кальцію може допомогти дезінфікувати зуб, де інфекція вже існує, її можна використовувати як короткочасне лікування для зменшення болю та запалення при підготовці до ендодонтичної хірургії (Gottfried Schmalz, 2009).
Вона служить добавкою для морської води, оскільки вона знижує атмосферний CO2 і пом'якшує парниковий ефект.
У виробництві металів вапно вводиться в потік відпрацьованих газів для нейтралізації кислот, таких як фториди і хлориди, до викиду в атмосферу.
Гідроксид кальцію використовується в якості активного лужного інгредієнта в деяких продуктах для релаксації волосся.
За даними Корнельського центру досліджень матеріалів, гідроксид кальцію може випрямляти кучеряве волосся, тому що він розриває дисульфідні зв'язки, що зв'язують цистеїни, амінокислоти, які присутні у більш високих концентраціях у природно кучерявих волоссях. Розрив цих зв'язків і їх герметизація гідроксидом кальцію постійно змінює фізичну структуру обробленого волосся.
У бордоській суміші гідроксид кальцію служить для нейтралізації розчину і утворює тривалий фунгіцид.
Застосовується в нафтопереробній промисловості для виготовлення масляних добавок (саліцилатів, сульфатів, фенолів), в нафтохімічній промисловості для виробництва твердих масел різних марок, а також у хімічній промисловості для виготовлення стеарату кальцію. , Зазвичай він використовується для дослідження поглинання вуглекислого газу та газу.
Гідроксид кальцію використовується при виготовленні гальмівних колодок, при приготуванні сухих сумішей для фарбування та декорування, а також у виробництві сумішей для пестицидів.
Він також використовується як добавка кальцію і рН / карбонатний буфер для коралової аквакультури в рифових акваріумах.
Це "альтернативний" природний інсектицид, більшість повзучих комах, що вмирають від контакту з ним, включаючи кліщі, бліх, жуків і личинок (Russiver, 2015).
Гідроксид кальцію є ефективним розчином для відділення волосся від шкіри тварин, при його підготовці до виробництва шкіри.
Суміш гідроксиду кальцію і теплої води створює ванну, в якій свіжі шкіри повинні просочуватися до чотирьох днів і часто струшуватися. Цей процес розпушує волосся і шкіру до такої міри, що його зазвичай можна зняти вручну.
У зв'язку з низькою токсичністю і м'якістю основних властивостей гашене вапно широко використовується в харчовій промисловості для:
- Уточнити сировинний сік цукрової тростини або цукрового буряка в цукровій промисловості, технологічну воду для алкогольних напоїв і безалкогольних напоїв, соління та інші продукти харчування.
- Зробіть кукурудзяні коржі (допоможіть кукурудзяній муці зібратися). Кукурудза, приготовлена з вапном, перетворюється на нікстамаль, що значно підвищує біодоступність ніацину, також вважається смачнішим і легше перетравлюється..
- Очистіть розсіл карбонатів кальцію і магнію у виробництві солі для харчового та фармацевтичного використання.
- Укріплені фруктові напої, такі як апельсиновий сік, і дитяча суміш (BAUM, 2013).
Список літератури
- BAUM, J. (2013, 16 серпня). Використання гідроксиду кальцію. Отримано з livestrong.com: livestrong.com.
- Гідроксид кальцію Формула - гідроксид кальцію Використання, властивості, структура і формула. (2005-2017). Отримано з softschools.com.
- Отруєння гідроксидом кальцію. (2017, 7 лютого). Отримано з medlineplus.gov.
- Хімічні дані КАЛЬЦІЮ ГІДРОКСИД. (S.F.). Отримано з cameochemicals.noaa.gov.
- Готфрід Шмальц, Д. А. (2009). Біосумісність стоматологічних матеріалів. Берлін: Спрингер.
- Паспорт безпеки матеріалу Гідроксид кальцію. (2013, 21 травня). Отримано з sciencelab: sciencelab.com.
- Національний центр біотехнологічної інформації. (S.F.). База даних PubChem Compound; CID = 6093208. Отримано з pubchem.ncbi.nlm.nih.gov.
- Королівське хімічне товариство. (2015). Гідроксид кальцію. Отримано з ChemSpider: chemspider.com.
- Russiver, M. (2015, 17 серпня). Для чого використовується гідроксид кальцію? Отримано з quora: quora.com.


